Как показано в текстах "Электромагнитный спектр химических элементов" а также "Спектры излучения и поглощения и законы Кирхгофа”, Спектры прерывистого излучения каждого химического элемента различны.

Итак, ниже у нас есть различные спектры некоторых из этих элементов:

Таким образом, датский физик Нильс Бёр (1885-1962) понял, что это может быть связано со структурой атома каждого из этих элементов. Поэтому он предложил модель атома, которая дополняла модель Резерфорда, но фокусировалась на поведении окружающих электронов в ядре атома.
Некоторое время назад Макс Планк (1858-1947) предложил теорию, согласно которой электроны квантованный, в том смысле, что они испускать и поглощать определенное количество энергии, как если бы они были небольшими пакетами энергии, который он назвал сколько (квант, в единственном числе).
Таким образом, Бёр предложил следующее: поскольку каждый элемент имеет различный спектр, каждый элемент имеет в своем атоме электроны постоянной и различной энергии от элемента к элементу.
Каждый электрон может оставаться только на определенной конкретной орбите, потому что на каждой из этих орбит электрон имеет постоянную, четко определенную и характерную энергию. Электрон может занимать только те энергетические уровни, для которых он имеет соответствующую энергию.
Спектры прерывистые, потому что электроны квантованы.
Электрон может менять уровни, только если он поглощает энергию. Например, когда вы сжигаете натриевую соль в горелке Бунзена, вы обеспечиваете энергию электронов. Поглощая квант энергии, электрон перескакивает на другой, более энергичный уровень, оставаясь в возбужденном состоянии. Однако основное состояние более стабильно, поэтому этот электрон излучает поглощенную энергию и возвращается на свою первоначальную орбиту. Он излучает эту энергию в виде электромагнитных волн, которые можно визуализировать в виде света. В случае натрия этот свет имеет интенсивный желтый цвет. Таким образом, когда эти волны проходят через призму, получается прерывистый спектр натрия.
Итак, для Бера каждая светящаяся линия, появившаяся в прерывистом спектре элементов, показывала энергию, выделяемую, когда электрон возвращался с одного внешнего уровня на один, более близкий к ядру.
Рисунок ниже помогает лучше понять эту проблему:
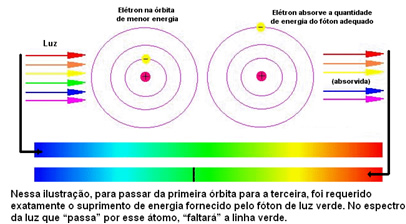
Поскольку атомам каждого элемента разрешены только определенные значения энергии, соответствующие энергетическим слоям, для каждого элемента существует свой спектр.
Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm
