межмолекулярные силы они представляют собой способы, которыми молекулы соединений (полярных или неполярных), образованных ковалентными связями, взаимодействуют друг с другом. Они были предложены в 1873 году голландским химиком и физиком Дидериком Ван дер Ваальсом.
Согласно Ван-дер-Ваальсу, молекулы могут по-разному взаимодействовать друг с другом. Эти различные взаимодействия имеют большое влияние на точка плавления (MP) и точка кипения (PE) веществ. Таким образом, интенсивность взаимодействия молекул определяет их физическое состояние (твердое, жидкое или газообразное).
Воспринимать существование различных межмолекулярных сил (взаимодействий) просто, поскольку в природе мы можем найти одну и ту же материю в разных физических состояниях. Теперь познакомьтесь с тремя типами межмолекулярных сил, которые могут существовать между веществами, образованными ковалентными связями:
→ Лондонские силы или дипольные
Это сила, возникающая между неполярные молекулы, то есть молекулы, не имеющие полюсов (положительных и отрицательных), поскольку электроны равномерно распределены в своей электросфере, как на изображении ниже:
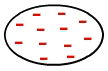
Равномерное распределение электронов в неполярной молекуле
Однако в какой-то момент электроны могут накапливаться в определенной области молекулы, создавая в ней отрицательный и положительный полюсы. Поскольку эта молекула находится близко к другой, этот временный диполь в конечном итоге заставляет электроны другой молекулы слипаться на одном конце и так далее:

Образование временного диполя в неполярной молекуле
Таким образом, молекулы, которые были неполярными, теперь имеют индуцированный диполь.
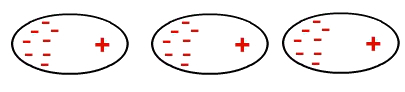
Взаимодействие неполярных молекул происходит индуцированно.
Вот некоторые примеры веществ, молекулы которых взаимодействуют посредством этого типа силы: диоксид углерода (CO2), газообразный метан (CH4), этановый газ (C2ЧАС6) и газообразный водород (H2).
Не останавливайся сейчас... После рекламы есть еще кое-что;)
→ Постоянная дипольная или диполь-дипольная сила
Это своего рода межмолекулярная сила, которая возникает между полярные молекулы (кроме тех, в которых элемент водород напрямую связан с фтором, кислородом или азотом). Некоторыми примерами веществ, молекулы которых взаимодействуют диполь-диполем, являются соляная кислота (HCl), диоксид серы (SO2), бромистоводородной кислоты (HBr) и синильной кислоты (HCN).
Поскольку молекулы полярны (у них есть положительный и отрицательный полюсы), они взаимодействуют таким образом, что отрицательный полюс одной соединяется с положительным полюсом другой, и так далее:
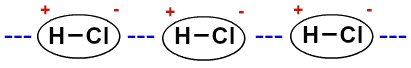
Представление постоянного диполя между молекулами соляной кислоты
Из-за наличия диполя, поскольку молекулы полярны, диполь-дипольное взаимодействие более интенсивно, чем индуцированный диполь.
→ водородные связи
Это тип межмолекулярной силы, которая также возникает в полярные молекулы, но только если атом водорода напрямую связан с одним из трех химических элементов (фтором, кислородом и азотом) плюс электроотрицательные Периодической таблицы.
Некоторые примеры молекул, которые взаимодействуют посредством водородных связей: фтористоводородная кислота (HF), аммиак (NH3) и вода (H2О).
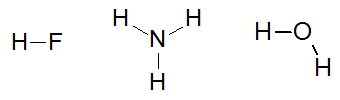
Структурные формулы веществ плавиковая кислота, аммиак и вода.
Как происходит водородная связь в молекулах, разность электроотрицательностей между атомами которых очень велика. большая, это межмолекулярная сила высокой интенсивности (больше, чем диполь-диполь и диполь индуцированный).
См. Изображение этого взаимодействия:
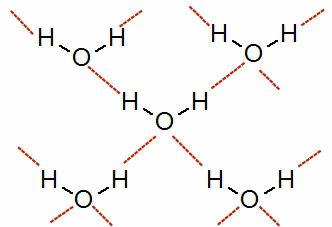
Представление водородных связей между молекулами воды
Автор: Диого Лопес Диас
Хотели бы вы ссылаться на этот текст в учебе или учебе? Посмотрите:
ДНИ, Диого Лопес. «Что такое межмолекулярные силы?»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-forcas-intermoleculares.htm. Доступ 28 июня 2021 г.