Представьте, что вы добавляете 10 г поваренной соли (хлорид натрия - NaCl) в стакан со 100 г воды при 20ºC. После перемешивания вы видите, что соль полностью растворилась, поэтому вы решаете добавить еще больше соли. В какой-то момент вы больше не сможете растворять соль в таком количестве воды, и любая добавленная соль будет опускаться на дно стакана, как бы вы ни пытались ее перемешать.
Когда это происходит, мы говорим, что решение насыщенный и что коэффициент растворимости. Следовательно, мы можем определить коэффициент растворимости следующим образом:
“Коэффициент растворимости - это максимальное количество растворенного вещества, которое растворяется в данном количестве растворителя при данной температуре ».
Коэффициент растворимости соли в воде, например, равен 36 г NaCl / 100 г воды при 20ºC. Невозможно растворить лишний грамм соли в таком количестве воды и при такой температуре, так как коэффициент растворимости индивидуален для каждого вещества. Если мы изменим растворенное вещество, например, заменив поваренную соль на NH
4Cl, это имеет коэффициент растворимости, равный 37,2 г в 100 г воды при 20 ° C.Более того, одно и то же вещество имеет разную растворимость в разных растворителях. Хотя соль растворима в воде, она практически не растворяется в ацетоне или этилацетате (растворитель, используемый для удаления глазури).
Другой момент заключается в том, что всякий раз, когда упоминается коэффициент растворимости растворенного вещества в данном количестве растворителя, также необходимо указать температуру, поскольку это мешающий фактор. Например, если мы возьмем 100 г воды при 20 ° C и добавим 40 г соли, 36 г солюбилизируются, а 4 г образуют осадок. Но если мы возьмем этот раствор на нагрев, мы увидим, что 4 г растворятся при повышении температуры.
Это показывает нам, что одно и то же растворенное вещество, растворенное в одном и том же количестве растворителя, имеет разные коэффициенты растворимости при повышении температуры.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
См. Пример ниже:
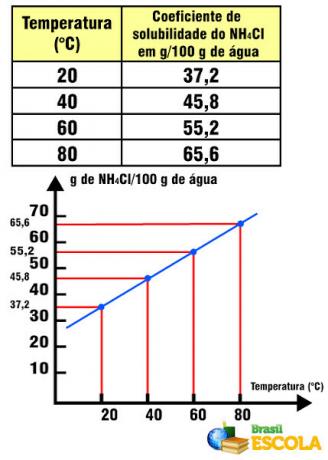
Коэффициент растворимости NH4Cl в зависимости от температуры
Отметим, что в этом случае коэффициент растворимости NH4Cl увеличивается с повышением температуры. Это происходит с большинством солей в воде. Однако бывают ситуации, когда коэффициент растворимости уменьшается с повышением температуры, как в случае Ce2(ТОЛЬКО4)3. Есть также случаи, когда нет такой заметной изменчивости коэффициента растворимости, как в случае с поваренной солью. См. Это в тексте Графики кривых растворимости.
Может случиться так, что в определенных конкретных ситуациях мы также сможем растворить в растворителе количество растворенного вещества, превышающее его коэффициент растворимости, таким образом получив так называемый перенасыщенный раствор. Например, представьте, что образовался раствор из 100 г воды при 20 ° C и 40 г поваренной соли (с 36 г растворяется и осаждается 4 г), нагревают до температуры, при которой все растворенные вещества растворите себя. Затем раствор оставляют в покое, чтобы он остыл, пока не достигнет комнатной температуры, близкой к 20ºC.
Если в растворе нет нарушений, излишки растворенного вещества останутся растворенными, образуя перенасыщенный раствор. Однако этот тип раствора очень нестабилен, и любое резкое движение может привести к кристаллизации количества, превышающего коэффициент растворимости для данной температуры. Таким образом, решение, которое было перенасыщенный станет насыщенный фоновым телом.
Последний случай - это ненасыщенный раствор, когда количество растворенного вещества меньше значения коэффициента растворимости. Примером может служить растворение 10 г NaCl в 100 г воды при 20 ° C.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Коэффициент растворимости»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm. Доступ 28 июня 2021 г.



