В тексте "Магматический электролиз», Было объяснено, что этот процесс происходит при пропускании электрического тока в расплавленном веществе (в жидком состоянии) без присутствия вода, и, таким образом, катион получает электроны, а анион отдает электроны, так что оба имеют электрический заряд, равный нулю, и энергию накоплено.
Чтобы лучше понять, как происходит магматический электролиз, давайте рассмотрим один из наиболее важных примеров этого типа процесса - электролиз хлорида натрия или поваренной соли (NaCl).
Хлорид натрия образуется в природе в результате передачи электрона от натрия (Na) к хлору (Cl) в соответствии с реакцией, приведенной ниже:
2Na (с) + 1Cl2(г) → 2NaCl (т)

Этот процесс является спонтанным, но обратный процесс этой реакции не является спонтанным, то есть образование газообразного хлора (Cl2(g) - рисунок ниже) и металлический натрий (Na (s)) в природе не встречается. Если мы хотим, чтобы это произошло, нам придется начать процесс.
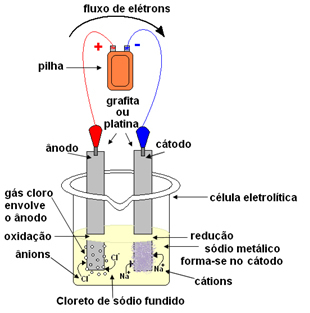
Это можно сделать с помощью магматического электролиза. Соль нагревается до температуры выше 800,4 ° C, что является ее температурой плавления; и таким образом он сливается, переходя из твердого состояния в жидкое. В этом физическом состоянии ваши ионы Na
+ и Cl- свободны.Затем расплав соли помещают в контейнер, электролитический сосуд, и два инертных платиновых или графитовых электрода погружают в хлорид натрия. Эти электроды подключены к источнику, генерирующему постоянный электрический ток, например к батарее или элементу.
При прохождении электрического тока происходит следующее:
- Отрицательный полюс батареи или элемента подает электроны к одному из электродов, который становится катодом;
- Катод: принимает электроны из ячейки и становится отрицательным полюсом, притягивая катионы Na.+, потому что притягиваются противоположные заряды. Эти ионы получают электроны от электрода (катода), и происходит их восстановление с образованием металлического натрия:
Снижение:В+(ℓ) + и- → В(s)
Металлический натрий откладывается поверх электрода и отправляется в резервуар.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
- Анод: становится положительно заряженным, привлекая анионы Cl- (поэтому он называется анодом). Эти ионы теряют свои электроны, когда они вступают в контакт с анодом, и, следовательно, подвергаются окислению, образуя атомы хлора, которые немедленно объединяются по два с образованием газообразного хлора:
Окисление:2Cl-(ℓ) → 2 и- + 1Cl2(грамм)
Этот газ пузырится вокруг анода и собирается стеклянной трубкой, адаптированной к системе.
Таким образом, общая реакция, возникающая в этом случае, определяется следующим образом:
Катод: 2Na+(ℓ) + 2e- → 2Na(s)
Анод: 2Cl-(ℓ) → 2 и- + 1Cl2(грамм) ____________
Глобальная реакция: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(грамм)
Еще один важный аспект, о котором следует помнить, который был выделен в конце упомянутого текста («Магматический электролиз»), - это то, что для электролиза происходит, элемент или батарея, используемые для генерации электрического тока, должны иметь ddp (разность потенциалов), равную или превышающую разность потенциалов реакция.
Давайте посмотрим на это в случае электролиза хлорида натрия, который мы рассматриваем. Чтобы найти разность потенциалов этой реакции, достаточно уменьшить стандартный восстановительный потенциал катода на потенциал анода. Это объясняется в тексте. Возможная разница батареи .
Через таблицу стандартных восстановительных потенциалов (E0красный), мы знаем, что:
В+(ℓ) + и- → В(s) А ТАКЖЕ0красный = -2,71
2Cl-(ℓ) → 2 и- + 1Cl2(g) И0красный = +1,36
Теперь просто уменьшите эти значения, чтобы узнать разность потенциалов глобальной реакции:
∆И0 = И0красный (катод) - А ТАКЖЕ0красный (анод)
∆И0 = -2,71 – (+ 1,36)
∆И0 = - 4,07 В
Следовательно, это означает, что используемый элемент или батарея должны иметь напряжение, равное или превышающее 4,07 В для проведения воспламеняющегося электролиза хлорида натрия.
Отрицательное значение указывает только на то, что это не спонтанный процесс.. В случае батарей, что является спонтанным процессом, значение электродвижущей силы (∆E0) всегда дает позитив.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Электролиз магматического хлорида натрия»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm. Доступ 28 июня 2021 г.
д) Это спонтанный окислительно-восстановительный процесс.
Химия

Применения электролиза, гальваники, никелирования, хромирования, никеля, хрома, катода, натрия, алюминия, хлора, каустическая сода, газообразный водород, магматический электролиз, водный электролиз, щелочные металлы, щелочноземельные металлы, газ хлор.
Химия

Электролиз, растворы электролитов, электрический ток, окислительно-восстановительные реакции, самопроизвольный химический процесс, химический процесс. несамопроизвольный, трансформатор, искусственное преобразование, промышленность, щелочные металлы, щелочноземельный, газообразный водород, газ cl


