О расчет атомная масса элемента - это математический ресурс, используемый для определения значения массы, присутствующей в Периодической таблице каждого из существующих химических элементов. В общем, чтобы провести расчет атомной массы, мы должны знать следующие переменные химический элемент:
Изотопы элементов;
Массовое число каждого изотопа элемента;
Процентное содержание каждого изотопа элемента в природе.
Например, расчет атомной массы водорода производился на основе следующих данных:
Представлены изотопы протия (H1), дейтерий (H2) и тритий (H3);
Массы этих изотопов равны 1, 2 и 3 соответственно;
Доля протия в природе составляет 98,9%;
Процентное содержание дейтерия в природе составляет 0,09%;
Процентное содержание трития в природе составляет 0,01%.
Математический стандарт для расчета атомной массы
Для проведения расчет атомной массы любого химического элемента мы должны использовать следующую математическую схему:
1О: умножьте массовое число каждого изотопа на его процентное содержание;
2О: сложить все результаты, полученные при умножении на первом шаге;
3О: полученную сумму разделите на 100.
M.A. = массовое число. процент + массовое число. процент
100
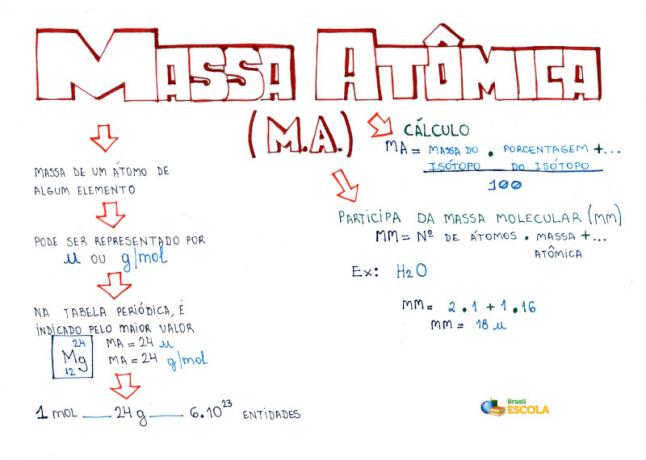
Интеллектуальная карта: атомная масса
* Чтобы скачать интеллектуальную карту в формате PDF, кликните сюда!
Примеры расчета атомной массы
⇒ 1-й пример: Расчет атомной массы Серы.
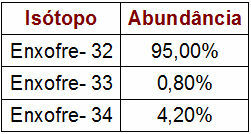
Процентные и массовые данные изотопов серы
В представленной таблице указаны массовое количество и процентное содержание каждого изотопа серы в природе. Чтобы выполнить расчет атомной массы, просто выполните следующие действия:
1О Шаг: умножьте массовое число каждого изотопа на значение его содержания.
Сера - 32 (S32)
s32 = 32.95
s32 = 3040
Сера - 33 (S33)
s33 = 33.0,8
s33 = 26,4
Сера - 34 (S34)
s34 = 34.4,2
s34 = 142,8
2О Шаг: сложите значения, полученные при умножении массового числа и содержания изотопа.
Сумма = S32 + S33 + S34
Сумма = 3040 + 26,4 + 142,8
Сумма = 3209,2
3О Шаг: вычислить атомную массу, разделив сумму найденных результатов на 100:
M.A. = Сумма
100
M.A. = 3209,2
100
M.A. = 32092 ед.
⇒ 2-й пример: Данный химический элемент (D) имеет три изотопа, массовые числа которых:
30D 32D 34D
Зная, что атомная масса этого элемента равна 32,20 u и что 20% изотопа 32D в природе, каково значение процентного содержания других изотопов?
В заявлении указаны массовые числа, атомная масса и процентное содержание одного из изотопов. Чтобы определить процентное содержание других изотопов, мы должны выполнить следующие шаги:
1О Шаг: определить процентное содержание каждого изотопа.
Изотоп - 30 (DS30)
DS30 = 30.x
DS30 = 30x
Изотоп - 32 (DS32)
DS32 = 32.20
DS32 = 640
Изотоп - 34 (D34)
DS34 = 34.y
DS34 = 34 года
2О Шаг: используйте все данные, найденные в математическом выражении, для вычисления атомной массы.
M.A. = массовое число. процент + массовое число. процент
100
32,2 = 30x + 640 + 34лет
100
32,2.100 = 30x + 640 + 34лет
100
3220–640 = 30x + 34 года
30x + 34y = 2580
х = 2580 - 34 года
30
3О Шаг: используйте приведенное выше выражение из следующих соображений:
Процент изотопа 1 + процент изотопа 2 + процент изотопа 3 = 100%
х + 20 + у = 100
х + у = 100-20
х + у = 80
х = 80 - у
2580 - 34 года = 80-лет
30
2580 - 34лет = 30. (80-е)
2580-34 года = 2400-30лет
2580–2400 = 34–30 лет
4y = 180
y = 80
4
у = 45%
4О Шаг: вычислить процентное значение x в выражении, построенном на третьем шаге.
х + у = 80
х + 45 = 80
х = 80–45
х = 35%
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/calculo-massa-atomica.htm