Electroliza este un proces utilizat pe scară largă de industria chimică, deoarece permite obținerea substanțe care nu există libere în natură, precum clor, iod, sodă caustică, printre alții.
Electroliza este opusul celulei, în care electricitatea se obține prin reacții redox, adică energia chimică este transformată în energie electrică. Deja în electroliză, electricitatea este utilizată pentru a produce reacții redox și energie chimică.
De aici și originea numelui său, fiind aceea electro înseamnă „curent electric” și liza înseamnă „rupere”. Exact asta se întâmplă, curentul electric rupe sau descompune substanța fiind supusă acestuia.
Bateria este un proces spontan, electroliza, totuși, este un proces non-spontan, care trebuie pornit cu ajutorul curentului electric.
Există două tipuri de electroliză: a de foc si în mediu apos. În acest text, ne vom ocupa de primul caz.
Diferența dintre electroliza magmatică și electroliza într-un mediu apos este forma în care se află substanța care va fi supusă unui curent electric.
În cazul electrolizei magmatice, substanța ionică se află în stare lichidă, adică topită, fără prezența apei. Cuvântul „aprins” provine din latină de foc, care înseamnă „ars, inflamat”.În electroliză, se folosește un recipient numit a Cuba sau celulă electrolitică, unde sunt montați doi electrozi prin care va trece curentul electric. Electrozii pot fi inert (nu se schimbă în timpul electrolizei) sau activ (Ei suferă un fel de schimbare în timpul electrolizei). Cele mai utilizate sunt inertele din platină sau grafit.
Electrozii sunt apoi conectați la o sursă de curent continuu (celulă sau baterie). Polul negativ al bateriei va furniza electroni la unul dintre electrozi, devenind încărcat negativ și va atrage cationii (ioni pozitivi) din substanța topită. Deoarece atrage cationii, acest electrod negativ se numește catod. În ea, cationii primesc electroni și se reduc.
Electrodul pozitiv atrage anioni (ioni negativi) și, datorită acestui fapt, se numește anod. Anionii își descarcă electronii la anod, suferind oxidare.
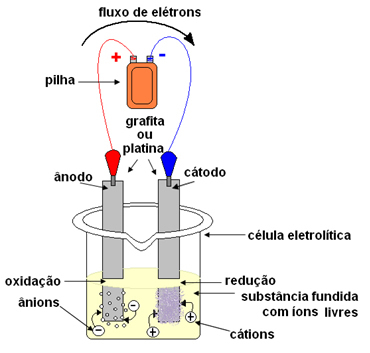
În baterii, electrodul pozitiv se numește catod, iar cel negativ este anodul. Aici în electroliză este opusul, anodul este polul pozitiv, iar catodul este polul negativ. Cu toate acestea, în ambele cazuri, în baterie și în electroliză, în anod există oxidare și în catod există reducere.
Pe scurt, avem:

Un alt fapt important este că celula sau bateria folosită pentru a genera curentul electric trebuie să aibă un ddp (diferență de potențial) egală sau mai mare decât diferența de potențial de reacție.
Pentru a înțelege mai bine modul în care are loc procesul de electroliză și cum descompune substanțele care produc elemente importante sau substanțe simple, citiți textul Electroliză clorură de sodiu ignegă.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm


