THE auto-oxi-reducere sau reacție disproporționată este un tip de reacție redox în care suferă același element chimic oxidare și reducere. Să vedem două exemple ale acestui tip de reacție și cum să le echilibrăm folosind metoda redox:
Primul exemplu:
LA2- + H+ → NU3- + NU + H2O
- Calculând numerele de oxidare (NOX) ale tuturor atomilor și ionilor implicați în reacție, este posibil să se verifice cine a oxidat și cine a reacționat:
+3 -2 +1 +5 -2 +2 -2 +1 -2
LA2- + H+ → NU3- + NU + H2O
- Rețineți că azotul a fost specia care a reacționat și oxidat:
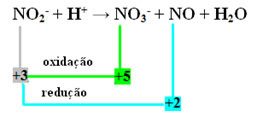
- Pentru a echilibra această reacție prin redox, trebuie să raportăm NOX la produse, nu la reactivi:
LA3- = ∆No = 5 - 3 = 2
NU = ∆Nox = 3 - 2 = 1
- Inversând ∆NOX prin coeficienți, avem:
LA3- = ∆NOX = 2 → 2 va fi coeficientul NO
NU = ∆NOX = 1→ 1 va fi coeficientul NO3-
LA2- + H+ → 1 LA3- + 2 NU + H2O
- Cu aceasta, știm deja că există 3 N în produs, deci coeficientul de NO2- va fi 3:
3 NU2- + H+ → 1 NU3- + 2 NU + H2O
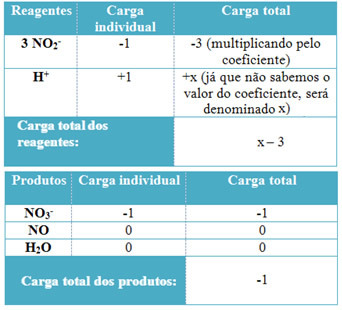
- Pentru a determina coeficienții lui H+ iar din H2O, amintiți-vă că numărul de electroni primiți este egal cu aceeași cantitate de electroni donați; astfel, taxa de reactiv va fi egală cu taxa de produs. În acest fel, putem realiza următoarea schemă:
Nu te opri acum... Există mai multe după publicitate;)
Pe baza acestor informații, avem că sarcina totală a reactivilor este egală cu x - 3 iar produsul este egal cu -1. După cum sa menționat, taxele celor doi trebuie să fie egale. Deoarece avem deja încărcătura totală de produse, putem efectua un calcul simplu pentru a ști care va fi valoarea lui x:
x -3 = -1
x = -1 +3
x = 2
Astfel, coeficientul lui H+ este 2 și, în consecință, cel al lui H2Va fi 1:
3 NU2- + 2 H+ → 1 NU3- + 2 NO + 1 H2O
Al 2-lea exemplu:
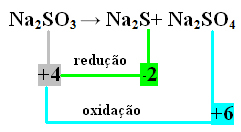
În acest caz, S a suferit reducere și oxidare în același timp. Astfel, așa cum am făcut anterior, putem raporta NOX la produse și le putem inversa valorile, atribuindu-le coeficienții:
La2 S = ∆Nox = 4 - (-2) = 6 → 6 va fi coeficientul Na2 NUMAI4
La2 NUMAI4= ∆Nox = 6 - 4 = 2 → 2 va fi coeficientul Na2 s
La2 NUMAI3→ 2 La2 Y + 6 La2 NUMAI4
Deoarece există 8 sulfuri în al doilea membru, coeficientul de Na2 NUMAI3 va fi 8:
8 în2 NUMAI3→ 2 in2 S + 6 In2 NUMAI4
De Jennifer Fogaça
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Reacții de autooxidare”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Accesat la 28 iunie 2021.


