O punctul de topire și fierbere sunt, respectiv, temperaturile la care materialele se schimbă de la solid la lichid și din lichid. pentru gaz sau temperatura maximă la care lichidul poate rămâne în această stare fizică într-o dată presiune.
Punctele de topire și fierbere ale elementelor chimice din tabelul periodic variază în funcție de numărul lor atomic, ceea ce înseamnă că sunt proprietăți periodice.
În Tabelul periodic, ordinea de creștere a temperaturilor de topire și fierbere a elementelor chimice urmează următoarea schemă de săgeți:
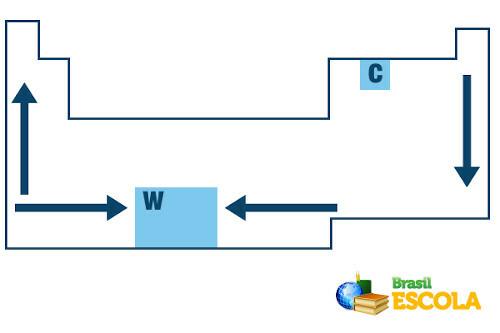
Creșterea punctului de topire și de fierbere în tabelul periodic
Rețineți că, atunci când luăm în considerare elementele care aparțin aceleiași familii în partea stângă a tabelului, punctele de topire și fierbere scad pe măsură ce numărul atomic al elementului crește, adică de jos până la sus. Acest lucru poate fi văzut în valorile punctului de topire și fierbere la 1 atm pentru elementele din familia 1 prezentate mai jos:

Puncte de topire și fierbere ale elementelor familiei 1
În partea dreaptă a Tabelului periodic, se întâmplă opusul, direcția de creștere a punctului de topire și de fierbere a elementelor aparținând aceleiași familii crește de sus în jos. Prin urmare, elementele cu cele mai scăzute temperaturi de topire și fierbere sunt situate în partea de sus a tabelului. Singura excepție este carbonul, care are un punct de topire de 3550 ° C și un punct de fierbere de 4287 ° C.
În caz contrar, majoritatea celor cu puncte de topire și fierbere reduse sunt fie gaze, fie lichide la temperatura camerei la nivelul mării. La fel ca și gazele nobile, azotul, oxigenul, fluorul și clorul, care se află în partea dreaptă sus a tabelului.
Acum, când vine vorba de elemente aparținând aceleiași perioade (același rând din tabel), vedem că punctele de topire și fierbere cresc de la laturi la centrul tabelului. Vedeți exemplul pentru elementele celei de-a doua perioade:
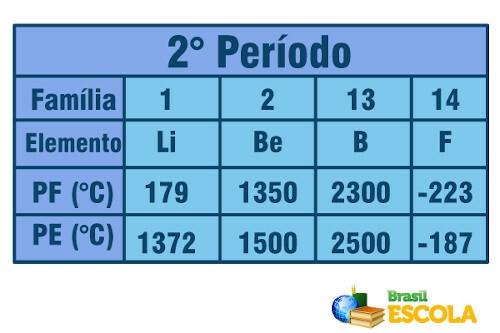
Punctul de topire și punctul de fierbere pentru elementele celei de-a doua perioade a Tabelului periodic
Tungstenul (W) este un element care se află în centrul tabelului periodic, iar punctul său de topire este cel mai ridicat dintre metale, fiind egal cu 3422ºC. De aceea este utilizat în filamentele cu becuri incandescente, deoarece poate rezista la temperaturi ridicate fără a se topi.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/ponto-fusao-ebulicaopropriedades-periodicas.htm
