În studiul Termologiei o numim transformări adiabatice acele transformări gazoase în care nu există schimb de căldură cu mediul extern. Prin urmare, în transformarea adiabatică căldura este zero.
Q = 0
Dacă aplicăm prima lege a termodinamicii, avem:
Q = ∆U + τ
∆U = - τ
Dar ce înseamnă că nu există schimb de căldură între mediul extern? Înseamnă că, dacă se produce o expansiune gazoasă și gazul efectuează o sarcină de 300 J, nu se întâmplă dacă există schimb de căldură cu mediul, variația energiei interne a gazului va fi negativă, prin urmare, noi vom avea:
∆U = - 300 J
Acum, dacă există o scădere a energiei interne a gazului, putem spune că a existat și o scădere a temperaturii gazului. Din legea generală a gazelor

putem spune că dacă volumul crește și temperatura gazului scade, neapărat va scădea și presiunea gazului. În general, putem spune că același lucru se întâmplă și cu compresia, deoarece dacă există compresie, energia internă a gazului va crește, deci și presiunea va crește.
Harta mentală: transformarea adiabatică
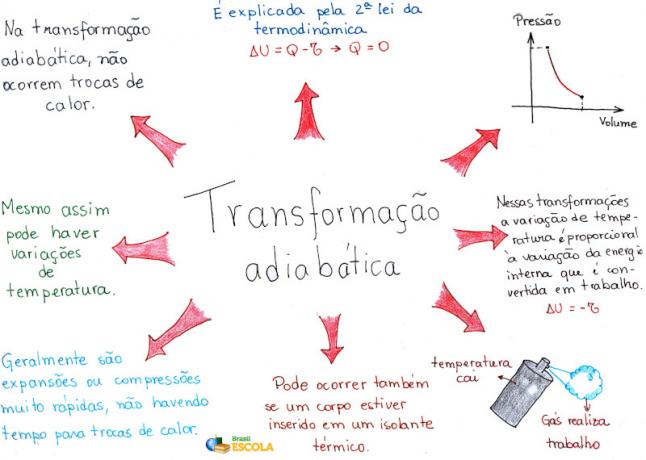
* Pentru a descărca harta mentală în format PDF, Click aici!
Pe scurt, putem spune că:
- în expansiunea adiabatică, temperatura și presiunea scad;
- în compresie adiabatică, atât temperatura, cât și presiunea cresc.
Graficul de mai jos ne oferă o imagine de ansamblu asupra transformării adiabatice:
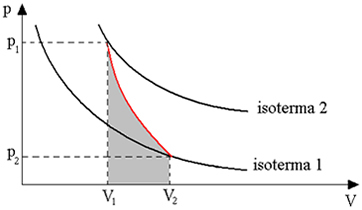
Transformările adiabatice se obțin folosind recipiente izolate termic sau prin compresie sau expansiune foarte rapidă.
Astfel, putem concluziona că, atunci când un gaz schimbă căldura cu mediul extern, este nevoie de ceva timp până când căldura se propagă prin masa gazoasă și ca aceasta să intre în echilibru. Prin urmare, atunci când se efectuează atât expansiunea, cât și compresia rapidă, practic nu există schimb de căldură cu mediul extern.
* Mind Map by Me. Rafael Helerbrock
De Domitiano Marques
Absolvent în fizică
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm


