O principiudăincertitudine, denumit și principiul incertitudinii Heisenberg, a fost menționat pentru prima dată în 1927, de către fizicianul german WernerHeisenberg (1901-1976). Acest principiu indică faptul că nu este posibil să se măsoare, simultan si cu precizie, cantități legate direct, cum ar fi viteză și poziţie a unui corp.
Uitede asemenea: Aspecte ale teoriei cuantice
Rezumatul principiului incertitudinii
Principiul incertitudinii raportează două cantități, cum ar fi poziția și impulsul sau energia și timpul, prin produsul incertitudinilor măsurătorilor efectuate asupra lor.
Conform principiului incertitudinii, cu cât poziția unui corp este mai precisă, cu atât este mai puțin precisă măsurarea impulsului său.
Principiul incertitudinii afirmă că este imposibil pentru noi să cunoaștem, cu precizie completă și în același timp, două mărimi fizice conexe, numite și cantități conjugate canonic.
Care este principiul incertitudinii Heisenberg?
O Principiul incertitudinii lui Heisenberg este un rezultat teoretic ciudat obținut prin calcule în zona
Mecanica cuantică, a cărui bază este exact acest principiu. Prin cunoașterea fizicii clasice, s-a crezut că, cunoscând poziția de pornire și viteza, mai mult în mod specific cantitatea de mișcare, a unui corp sau a unui sistem de corpuri, ar fi posibil să se prevadă comportamentul acestuia în momentele viitoare. În acest fel, ar fi posibil să se calculeze poziții ulterior, determinarea lui traiectorie, valori ale accelerare,viteză,energie, etc. Cu toate acestea, principiul incertitudinii arată că, chiar dacă am avea Mai multnecesar instrumentelor de măsurare la îndemână, nu ne-ar fi posibil să știm, simultan si cu precizie, măreție ca. poziţie și cantitateaînmișcare sauenergie și pauzăîntimp de același corp.Uitede asemenea: Cantitatea de mișcare
Deci, conform acestui principiu, dacă putem determina poziţie unui corp cu o precizie totală, vom pierde complet măsura lui cantitateaîncirculaţie, întrucât imprecizia despre aceasta va fi considerată infinită. La fel, dacă putem fi siguri cu privire la cantitatea de mișcare a unui corp, nu va fi posibil să știm poziția acestuia.
Același lucru este valabil și pentru cei mari energie și timp: dacă știm exact cantitatea de energie dintr-o particulă, vom pierde precizia în măsurătorile de timp. La fel, dacă știm cât a durat un eveniment cu o anumită particulă, am pierde total informații despre cantitatea de energie prezentă în ea.

Datorită principiului incertitudinii, este imposibil ca cel mai mic nivel de energie al unui corp să fie zero.
Uitede asemenea: Ce este energia?
Nu toate mărimile fizice sunt legate între ele pentru gradul lor de precizie. Este posibil, de exemplu, să se determine energie si poziţie a unei particule fără ca precizia acestor măsurători să fie inversproporţional reciproc.
În plus, principiul incertitudinii impune că produsul incertitudinilor a două cantități, cum ar fi poziția și impulsul, va fi întotdeauna mai mare sau egal cu Constanta lui Planck (h) împărțit la 4π. Este comun, totuși, să vedem ecuația principiului incertitudinii scris în termeni de constantă a lui Planck redus (? = h / 2π).
Principiul incertitudinii lui Heisenberg, care se referă la incertitudinedăpoziţie a unui corp cu incertitudinea impulsului său, este definit prin ecuația de mai jos:
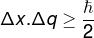
Δx - incertitudine de poziție (m)
q - incertitudinea impulsului (m / s)
? - constantă Planck redusă (1.0545.10−34 J.s)
Principiul incertitudinii se aplică și energiei și intervalului de timp al unui corp. Ceas:

Δ Și -incertitudine în energie (J)
t -incertitudine în timp (e)
Să presupunem, de exemplu, că, într-un experiment dat, doriți să măsurați poziţie a unui electron. Pentru a-i putea măsura poziția, este necesar ca, cumva, să fie emis un foton către acest electron. Cu toate acestea, atunci când foton este reflectat înapoi către observator, electronul se retrage, deoarece fotonul îi transferă o cantitate mică de mișcare direct proporțională cu frecvență. Dacă dorim să determinăm mai precis poziția acestui electron, putem crește frecvența fotonului. Cu toate acestea, dacă facem acest lucru, vom crește cantitatea de mișcare dată electronului, pierzând astfel precizia în măsurarea acestei magnitudini.
Uitede asemenea: Ce este teoria corzilor?
Exercițiu rezolvat pe principiul incertitudinii
O măsurare de laborator extrem de precisă este capabilă să determine poziția unei molecule cu incertitudini de măsurare de ordin egal cu ± 10-15 m. Conform principiului incertitudinii, care este cea mai mică incertitudine posibilă în măsurarea impulsului acestei molecule?
Rezoluţie
Principiul incertitudinii afirmă că produsul poziției și impulsului incertitudinilor trebuie să fie mai mare sau egal cu jumătate din constanta Planck redusă:

Astfel, luând modulul incertitudinii poziției (Δx = 10-15) furnizat de exercițiu și de modulul constant al Planck redus (? = 1,0545.10−34 J.s), va trebui să:

Rezultatul de mai sus indică faptul că, chiar dacă laboratorul are un instrument capabil să măsoare cantitatea de mișcare a acestei particule cu erori mai mici decât 10-20 m, nu va fi posibil să-i măsurăm valoarea cu precizie. Deci, vom avea întotdeauna valoarea calculată mai sus ca o abatere plus sau minus.
De mine. Rafael Helerbrock
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-principio-incerteza.htm