Reacții de sulfonare în alcani sunt reacții de substituție organică, realizat cu scopul de a produce acizi sulfonici (compuși organici care au grupa SO3H atașat la un atom de carbon sau la un lanț de carbon) și la apă (H2O).
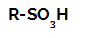
Formula structurală a unui acid sulfonic
Pentru efectuarea unei reacții de sulfonare pe alcani, trebuie să amestecăm un alcan (compus format dintr-un lanț de carbon saturat doar cu atomi de carbon și hidrogen) și acid sulfuric (H2NUMAI4) concentrat, supus încălzirii (∆).
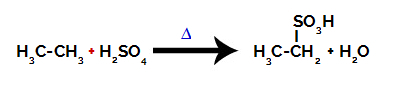
Ecuație chimică reprezentând sulfonarea unui alcan cu doi carbon
Principiile reacției de sulfonare în alcani
Ca reacție de sulfonare cu alcani este o reacție de substituție, avem în ea un schimb între componente mai mici electronegativitate dintre reactanți, adică între alcan și acid sulfuric. Alcanul are hidrogen, iar acidul sulfuric, grupul sulfonic.
Mai jos, avem pas cu pas mecanismul unui reacție de sulfonare în alcani. De exemplu, vom folosi cel mai simplu alcan, metanul (CH4):
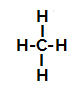
Formula structurală a metanului
Pasul 1: Întreruperea legăturii dintre hidroxil (OH) și sulf (S) în acid sulfuric.
Fiecare grupare hidroxil prezentă în acidul sulfuric se caracterizează prin faptul că este mai electronegativă. Odată cu încălzirea în timpul reacției, tendința este că legătura dintre gruparea hidroxil și sulf se rupe:
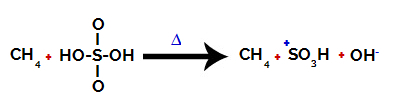
Întreruperea legăturii dintre sulf și hidroxil
Cu toate acestea, ruperea legăturii tuturor hidroxililor nu are loc din cauza rearanjării electronice a structurii. Se obține apoi un anion hidroxid (OH).-) și un cation sulfonic.
Pasul 2: Atacul grupului hidroxil asupra moleculei de alcan.
Apoi gruparea hidroxi (OH-) efectuează un atac asupra alcanului, provocând ruperea legăturii dintre carbon și hidrogen (care este mai fragilă din cauza diferenței de electronegativitate dintre aceștia).
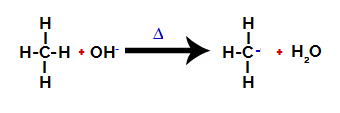
Ruperea legăturii dintre carbon și hidrogen în alcan
Notă: Întreruperea legăturii dintre carbon și hidrogen va apărea întotdeauna cel mai frecvent pe carbonul cu densitate sau sarcină electronică mai mică. Cu cât are mai puțini hidrogeni de carbon sau cu cât sunt mai multe grupuri atașate la acesta, cu atât este mai mică densitatea sa de electroni. Deci avem:
Carbon terțiar
După ce legătura este ruptă, alcanul devine un carbon cu deficit de electroni (carbocație). Grupul hidroxid (OH)-) interacționează cu hidrogenul eliberat și formează o moleculă de apă.
Pasul 3: Atacul radicalului format asupra grupării sulfonice.
În cele din urmă, gruparea sulfonică este atacată de restul alcanului, formând un acid sulfonic.
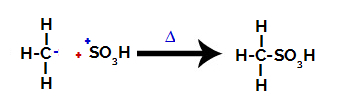
Structuri care interacționează și formează acid sulfonic
Exemple de ecuații care reprezintă reacții de sulfonare în alcani
Primul exemplu: Sulfonarea propanului.
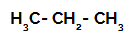
Formula structurală a propanului
Propanul are doi carboni primari și unul carbon secundar, care au sarcini diferite, deoarece sunt legați de cantități diferite de hidrogen. Deoarece carbonul este mai electronegativ decât hidrogenul, acești carboni au densități diferite de electroni.
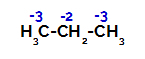
Distribuția sarcinilor pe fiecare atom de carbon de propan
La carbonii primari, sarcina este -3 (deoarece este legată de trei hidrogeni), iar la carbonul secundar, sarcina este -2 (deoarece este legată la doi hidrogeni). Astfel, va exista o rupere a legăturii dintre carbon și hidrogen, uneori la carbonul 1 (al unei molecule), uneori la carbonul 2 (al altei molecule).
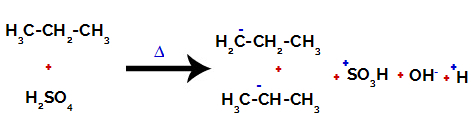
Ruperea legăturii dintre carbon și hidrogen pe diferiți atomi de carbon
După pauzele dintre legături, atât în acid sulfuric, cât și în alcan, se formează produse cu înlocuirea hidrogenului pe carbonul 1 cu o grupare sulfonică și același lucru se întâmplă și pe carbon 2.
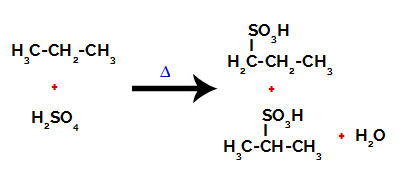
Produse formate din sulfonarea propanului
Al 2-lea exemplu: Sulfonarea 2-metil-butanului.

Formula structurală a 2-metil-butanului
2-metil-butanul are trei carboni primari, un carbon secundar și un carbon terțiar, care au sarcini diferite și, în consecință, densități electronice diferite, așa cum se poate vedea în următoarea structură:
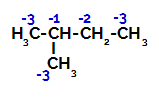
Distribuirea taxelor electronice în 2-metil-butan
Prin urmare, există în 2-metil-butan mai multe posibilități de rupere a legăturii dintre carbon și hidrogen, care poate apărea pe carbonul 1 (al unei molecule), carbonul 2 (al altei molecule), carbonul 3 sau carbonul 4. Cu toate acestea, este de remarcat faptul că perturbarea la numărul de carbon 2 este mai frecventă.
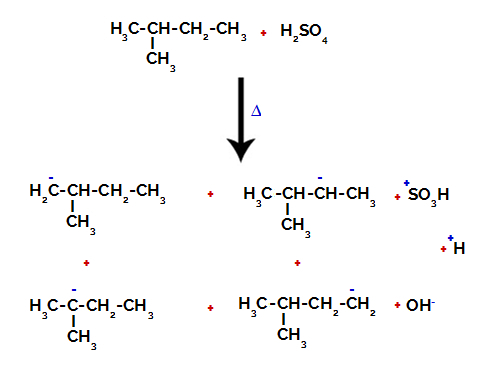
Ruperea legăturii dintre carbon și hidrogen pe diferiți atomi de carbon
După ruperea dintre legături, atât în acid sulfuric, cât și în alcan, se formează produse cu înlocuirea hidrogenului pe carbonul 1 cu o grupare sulfonică și la fel se întâmplă și pe carbon 2.

Produse formate din sulfonarea 2-metil-butanului
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
