In text "Titlu sau procentaj de masă”Am văzut cum să calculăm raportul dintre masa solutului și masa soluției, pentru soluțiile solide, lichide și gazoase. Cu toate acestea, în acest text vom vedea că este posibil să se calculeze și titrul în termeni de volum, pentru soluții cu componente lichide sau gazoase.

Titlul în volum poate fi calculat prin expresia:
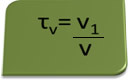
Să luăm ca exemplu o soluție apoasă de alcool etilic folosită ca antiseptic și dezinfectant, care a fost preparat prin adăugarea a 70 ml alcool pur în suficientă apă pentru a alcătui un volum de 100 ml soluţie. Deci avem:
τ = 70 ml = 0,7
100 ml
Putem exprima și titlul în procente, înmulțind doar rezultatul cu 100%. Deci, în acest caz, avem o soluție de alcool etilic de 70%, ceea ce înseamnă că din fiecare 100 de unități de volum ale soluției, 70 de unități de volum sunt alcool.
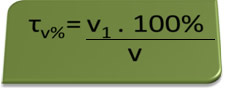
În cazul de mai jos, avem o soluție de alcool etilic 70% într-un volum de soluție de 250 ml; ceea ce înseamnă că 175 ml sunt alcool, conform calculelor:
100 ml 70 ml alcool
250 ml x
x = 70. 250
100
X = 175 ml alcool

Cu toate acestea, nu putem spune că, în acest caz, avem 75 ml (250-175) de apă. Spre deosebire de titrul de masă, în care putem adăuga masa solventului la masa solutului pentru a găsi masa soluției, acest lucru nu se poate face în raport cu titrul de volum.

Aceasta înseamnă că volumul soluției nu este egal cu suma volumului solventului și a volumului dizolvat (deși adesea diferența poate fi considerată neglijabilă). Acest lucru se datorează faptului că forțele intermoleculare care există în aceste lichide influențează volumul final.
În cazul soluției menționate mai sus, de alcool etilic, de exemplu, atunci când amestecăm alcoolul cu apă, există o contracție a volumului total al soluției; adică volumul final va fi mai mic decât dacă am adăuga singur volumul de alcool și apă. Acest lucru se datorează faptului că moleculele de alcool stabilesc legături sau legături de hidrogen cu moleculele de apă, reducând spațiile dintre ele.
Prin urmare, în acest și în alte cazuri, volumul soluției trebuie măsurat experimental atunci când nu este furnizat în exercițiu.
Procentul în volum este utilizat pe scară largă în cazurile de băuturi alcoolice și alcool comercial, așa cum s-a menționat mai sus. Vedeți două aplicații importante ale acestui calcul:
- Aparat etilotest: etilotestul măsoară concentrația alcoolului etilic în sânge, iar în Brazilia este interzis oricui să conducă orice tip de vehicul cu un conținut de alcool din sânge egal sau mai mare de 0,1% în volum. O persoană cu acest conținut de alcool are, pentru fiecare litru de sânge, 1 ml de alcool, după cum se arată în următoarele calcule:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 L = 1 ml
100%

- Conținut de etanol în benzină: în Brazilia, benzina este reglementată prin adăugarea de etanol. Dar conținutul de etanol din benzină trebuie să fie cel mult 24% din volum de alcool anhidru (deoarece benzina trebuie să fie lipsită de apă). Cu cât se adaugă mai mult etanol la benzină, cu atât culoarea combustibilului devine mai deschisă și densitatea acestuia crește.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm

