Disocierea de baze este un proces fizic care apare cu acest grup important de substanțe anorganice atunci când acestea sunt dizolvate în apă sau când trec prin procesul de fuziune (trecerea de la starea solidă la starea lichidă prin Incalzi).
În general, fenomenul de disocierea bazei este eliberarea cationilor și anionilor care formează compus ionic, care, în acest caz, este baza. Deci, în timpul disocierea bazei, eliberarea lui ioni care există deja în compus, adică nu se formează ioni noi.
Baza este formată din orice metal (X), care este cationul compusului sau de cationul de amoniu (grupa NH4+), legat de anionul hidroxid (reprezentat de grupul OH), ca în reprezentările de mai jos:
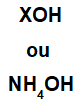
Reprezentări generale ale unei formule de bază
forma de reprezinta disocierea bazei se face printr-o ecuație în care, în reactant, avem baza și, în produse, avem ioni (cationi și anioni). Ceea ce face diferența este modul în care are loc disocierea:
Dizolvarea bazei în apă:
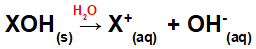
Ecuație reprezentând disocierea unei baze într-un mediu apos
Disocierea prin fuziune de bază:
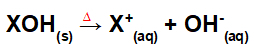
Ecuație reprezentând disocierea unei baze prin procesul de fuziune
Analizând ecuațiile generale de mai sus, verificăm că în toate vom avea întotdeauna baza, cationul (care este grupul metalic sau NH4+) și anionul (OH-). Dar sunt toți așa? Nu există nicio diferență între ele? Pentru prima întrebare răspunsul este nu și pentru a doua întrebare răspunsul este da.
Când efectuăm disocierea de o bază, este fundamental mai întâi să analizăm formula de bază, deoarece, din aceasta, putem determina încărcătura cation și cantitatea de mol de anioni hidroxid, deoarece cantitatea de mol de cation este standard (întotdeauna 1 mol).
Merită să ne amintim că cantitatea de grupe OH prezente în formula bazei determină sarcina cationului și cantitatea în mol a anionului hidroxid în disocierea bazei.
Să vedem exemplele de hidroxid de aluminiu [Al (OH)3] și hidroxid de aur (AuOH). În formula de bază de aluminiu, există trei grupe OH, iar în formula de bază aurie, o singură grupă OH. Astfel, în disocierea acestor baze, avem:
Disocierea Al (OH)3:
Deoarece această bază are trei grupe OH în formulă, sarcina pe cation va fi +3 și cantitatea în mol de anioni este egală cu 3 mol, așa cum putem vedea în următoarea ecuație:
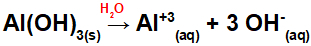
Ecuația de disociere a bazei de aluminiu în mediu apos
Disocierea de AuOH:
Deoarece această bază are un grup OH în formulă, sarcina pe cation va fi +1 și cantitatea în mol de anioni este egală cu 1 mol, așa cum putem vedea în următoarea ecuație:
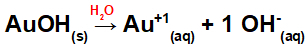
Ecuația disocierii bazei cu aurul în mediu apos
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm

