THE electronegativitate este tendința unui atom de a atrage electroni spre sine când este legat de un alt element chimic. printr-o legătură covalentă, adică în care sunt împărțiți electronii, considerând această moleculă ca fiind izolat.
Să luăm în considerare două exemple pentru a înțelege mai bine conceptul prezentat:
Primul exemplu: Molecula de hidrogen gazos: H2 → H - H
Când doi atomi de hidrogen se reunesc, forțele de atracție dintre nucleul fiecăruia apar simultan. unul dintre acești atomi de către electronul celuilalt atom și forțele de repulsie între electroni și nucleele celor doi atomi. Când aceste forțe ajung la echilibru, cei doi electroni se află într-o regiune a electrosferelor care este undeva între cele două. atomii moleculei, în care ambii interacționează cu cei doi electroni, devenind stabili, adică cei doi atomi împărtășesc o pereche de electroni.
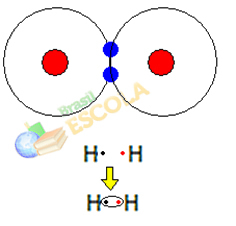
Aceasta este o legătură covalentă, care formează o moleculă. Dar, din moment ce cei doi atomi ai acestei molecule sunt exact aceiași, felul în care atrag electroni unul către celălalt este, de asemenea, același. Deci spunem asta
nu există nicio diferență de electronegativitate sau că ea este apolar.Exemplul 2: Molecula de clorură de hidrogen: HCℓ
În acest caz, partajarea unei perechi de electroni se realizează între diferite elemente, deoarece, în acest sens, atomul de clor atrage electroni cu intensitate mai mare decât hidrogenul. Prin urmare, spunem că clorul este mai electronegativ decât hidrogenul.
După cum se arată în figura de mai jos, datorită diferenței de electronegativitate, a dipol electric (μ), care sunt doi monopoli electrici, cu electroni care tind să fie mai atrași de clor. Deci legătura H ─ Cℓ va avea o sarcină negativă parțială asupra clorului (δ-) și o sarcină parțială pozitivă pe hidrogen (δ+). Deci aceasta este o moleculă cu diferență de electronegativitate si este polar:
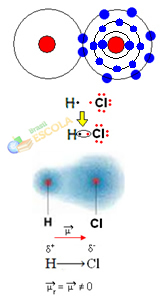
Acest lucru ne arată că electronegativitatea este relativ mai degrabă decât o cantitate absolută, deoarece este determinată luând în considerare comparațiile forțelor exercitate de atomi într-o legătură covalentă.
Există mai multe moduri de a calcula electronegativitatea, dar cea mai comună este scara electronegativității propusă de Pauling. Să presupunem că avem o moleculă generică A ─ B. Pauling a propus ca energia de legare a acestei molecule, simbolizată de D, să fie dată de suma mediei aritmetice a energiilor de legare (D) a moleculelor de gaz ale acestor doi atomi, adică A-A și B-B, cu pătratul diferenței de electronegativități a fiecărui atom al acelei molecule (XTHE și xB):
D(A-B) = [D(A-A) + D(B-B)] + k (xTHE - XB)2
Constanta k din formula de mai sus este egală cu 96,5 kJ. mol-1. Pauling a atribuit o valoare arbitrară pentru electronegativitatea hidrogenului, care era 2,1 și, în acest fel, a fost posibil să se descopere valoarea electronegativității celorlalte elemente în raport cu el.
Pe baza acestei metode, valorile electronegativității Pauling au fost date pentru elementele din Tabelul periodic, cu excepția gazelor nobile.

Rețineți că aceste valori sunt o proprietate periodică deoarece variază periodic în funcție de numărul atomic al elementelor. Vezi, de exemplu, că cele mai electronegative elemente sunt cele din colțul din dreapta sus al mesei, adică fluor (4.0) și oxigen (3.5), iar cel mai puțin electronegativ sunt cele din colțul din stânga jos, care sunt franciu (0.8) și cesiu (0,8).
Pe baza acestui fapt, s-a creat chiar un rând de electronegativitate a celor mai electronegative elemente care tind să fie cel mai mult lucrate:
F> O> N> Cℓ> Br> I> S> C> P> H
Vedeți valorile electronegativității:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Există un fel de „truc” pentru a decora acest rând de electronegativitate, care este dat de propoziția de mai jos, în care inițiala fiecărui cuvânt corespunde simbolului elementelor în cauză:
“FSalut Onu am NO Clube, fram EusUch Çmoarte Ppentru Hspital"
Deci putem spune asta electronegativitatea este o proprietate periodică care crește de la stânga la dreapta și de jos în sus în Tabelul periodic.

Acest lucru se datorează dimensiunii razei atomice. Cu cât raza unui atom este mai mare, cu atât electronii împărțiți sunt mai îndepărtați de nucleul său și, prin urmare, cu atât este mai slabă atracția dintre ei. Opusul este, de asemenea, adevărat, cu cât raza atomică este mai mică, cu atât electronii vor fi mai aproape de nucleu și cu atât este mai mare atracția dintre ei. Astfel, putem concluziona următoarele:
Electronegativitatea crește odată cu scăderea razei atomice.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/eletronegatividade.htm
