Baza este substanță anorganică care, potrivit chimistului suedez Svante Arrhenius, atunci când este plasat în apă, suferă fenomenul de disocierea ionică, în care există eliberarea lui ioni: cation (Y+) și anionul hidroxid (OH-).

Formula generală a unei baze Arrhenius
grupul Y al unui baza poate fi orice metal sau altfel din grupul amoniu (NH4+), care sunt eliberați în apă ca cationi în timpul disocierii, așa cum se poate vedea în ecuația care reprezintă procesul:
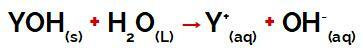
Ecuație reprezentând disocierea unei baze
Vezi mai jos câteva informații foarte importante cu privire la clasificarea și nomenclatura baze.
1) Clasificare privind solubilitatea bazelor(capacitatea de a a dizolva in apa)
Bazele solubil: au metal alcalin sau amoniu în compoziție;
Bazele Solubil cu moderație: avea metal alcalin pământos în compoziție. Exemplu: hidroxid de magneziu, utilizat pe scară largă ca antiacid și laxativ;
baze practic insolubil: au orice alt metal în compoziție. Exemplu: hidroxid de aluminiu, utilizat pe scară largă ca antiacid.
2) Clasificare privind puterea de bază(capacitatea de a disocia in apa)
Bazele puternic: au în compoziție metale alcaline sau alcalino-pământoase, cu excepția magneziului;
Bazele slab: au orice alt metal în compoziție.
3) Nomenclatura de bază
Pentru a denumi o bază, trebuie doar să urmați regula de numire de mai jos:
Hidroxid + de + denumirea metalului sau a amoniului
Exemplu: Ca (OH)2 → hidroxid de calciu
Dacă baza are un element chimic care nu aparține familiilor IA, IIA sau IIIA (și acesta nu este argint sau zinc), trebuie să indicăm în fața numelui elementului, cu cifre romane, numărul de hidroxili:
Exemplu: Ti (OH)4 → hidroxid de titan IV
De mine. Diogo Lopes
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm
