THE Cinetica chimică este un domeniu care studiază factorii care influențează rata de dezvoltare a reacțiilor chimice, adică viteza cu care au loc. Există din ce în ce mai multe cercetări în această zonă, deoarece vrem adesea să accelerăm unele reacții sau să încetinim altele. Acest lucru este deosebit de important pentru industrii și această cercetare are consecințe tehnologice importante.
Dar, deoarece viteza unei reacții poate varia la fiecare interval de timp și de la o substanță la alta, este obișnuit să se calculeze viteza medie de reacție.
Luați în considerare următoarea reacție generică, în care coeficienții sunt literele mici, iar reactanții și produsele sunt reprezentate de literele mari:
a A + b B → c C + d D
Viteza medie a acestei reacții va fi dată împărțind rata medie de reacție a oricăreia dintre substanțele care reacționează sau rata medie de formare a oricăruia dintre produse la coeficientul său respectiv din ecuația chimică. Aceasta este dată de:
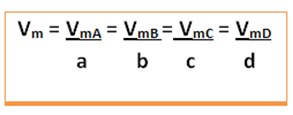
De exemplu, luați în considerare reacția de descompunere a peroxidului de hidrogen:
2 ore2O2 (aq) → 2 H2O(1) + 1 O2 (g)
Să spunem că în 1 minut s-a format 0,3 mol / L de H2O și 0,15 mol / L de O2, în timp ce 0,3 mol / L de H s-a descompus2O2, adică, ratele medii de descompunere și formare a acestor substanțe în reacție sunt:
VmH2O2 = 0,3 mol / L. min
VmH2O = 0,3 mol / L. min
VmO2 = 0,15 mol / L. min
Viteza medie a reacției globale va fi găsită luând una dintre aceste valori și împărțind-o la coeficientul respectiv din ecuație:
Vm = VmH2O2 = 0,3 mol / L. min = 0,15 mol / L. min
2 2
Vm = VmH2O = 0,3 mol / L. min = 0,15 mol / L. min
2 2
Vm = VmO2 = 0,15 mol / L. min = 0,15 mol / L. min
1 1
Rețineți că cele trei valori sunt egale, prin urmare, viteza de reacție este aceeași ca o funcție a oricărui reactant sau produs, în același interval de timp.
Totuși, cum s-au găsit valorile vitezei medii ale fiecăreia dintre substanțele implicate în aceste reacții?
Se poate calcula împărțind variația concentrației substanței (reactiv sau produs) la intervalul de timp. Dacă vom determina viteza medie a unuia dintre reactivi a reacției, va trebui să punem un semn negativ înainte sau altfel luați în considerare valoarea concentrației în modul ||, deoarece, din moment ce concentrația reactantului scade în timp, valoarea vitezei ar fi negativă, dar nu există o viteză negativă.

De exemplu, luați în considerare următoarea reacție de descompunere a gazului de ozon (O3 (g)) în oxigen gazos (O2 (g)):
2 O3 (g) → 3 O2 (g)
Să spunem că într-un balon erau 10 moli de ozon gazos, dar după 1 minut au rămas doar 4 moli; asta înseamnă că 6 moli de ozon s-au transformat în oxigen gazos. Deci avem:
2 O3 (g) → 3 O2 (g)
t = 0 min 2 mol / L 0 mol / L
cheltuieli formate
6 mol / L 9 mol / L
t = 1 min 4 mol / L 9 mol / L
Rețineți că, deoarece raportul de reacție este 2: 3, atunci dacă s-au folosit 6 moli de O3, S-au format 9 mol de O2. Deci, după 1 minut, avem următoarele viteze medii:
Vm = - ∆ [The3]
t
Vm = - ([O3finală - O3initial])
tFinal - tiniţială
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / L. min→ Timp de 1 minut, 6 mol de ozon au reacționat în fiecare litru al sistemului.
Vm = ∆ [The2]
t
Vm = ([O2finală - O2initial])
tFinal - tiniţială
Vm = ([9 - 0])
1– 0
Vm = 9 mol / L. min→ În decurs de 1 minut, s-au format 9 moli de oxigen în fiecare litru al sistemului.
Acest lucru ne arată că putem calcula viteza medie în funcție de reactanți sau în funcție de produse.
Acum, dacă vrem să calculăm viteza medie a acestei reacții globale, procedăm așa cum am arătat la început: împărțiți fiecare dintre aceste viteze la coeficienții lor respectivi în ecuația chimică:
Vm = VmO3 = 6 mol / L. min = 3 mol / L. min
2 21
Vm = VmO2 = 9 mol / L. min = 3 mol / L. min
3 3
Vm = VmO3 = VmO2
23
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm
