Unii compuși nu trebuie să aibă opt electroni în învelișul de valență pentru a obține stabilitate, deci sunt considerați excepții de la regula octetului. Aflați acum de ce unele elemente scapă de obligația de a avea un octet de electroni în ultima coajă.
Beriliu (Fi)
Este o excepție de la regula Octet, deoarece este capabilă să formeze compuși cu două legături simple, deci se stabilizează cu doar patru electroni în învelișul de valență. 
Deoarece hidrogenul (H) trebuie să renunțe la doi electroni pentru a face legătura (H - Ei bine - H), atomul de beriliu (Be) își împarte electronii și obține stabilitate.
Aluminiu (Al)
Este o excepție de la regula Octet, deoarece atinge stabilitatea cu șase electroni în carcasa de valență. Atomul de aluminiu tinde să-și doneze electronii și astfel poate forma trei legături simple cu alți atomi: 
În acest caz, aluminiul (Al) a format trei legături cu trei atomi de fluor (F).
Bor (B)
Formează substanțe moleculare cu trei legături simple. 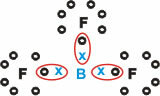
Rețineți că borul (B) tinde să-și doneze electronii atomilor de fluor (F), care se supune regulii octetului, necesitând opt electroni în învelișul de valență. Pe măsură ce borul renunță la electroni, fluorul se stabilizează odată cu octetul format.
De Líria Alves
Absolvent în chimie
Echipa școlii din Brazilia
Vezi mai mult!
Teoria Octetului
Chimie generală - Chimie - Școala din Brazilia
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm

