Hibridizare este denumirea dată fuziunii sau unirii orbitalilor atomici incompleti, fenomen care crește numărul de legaturi covalente ceea ce poate face un atom. Amintindu-ne că orbitalul este regiunea atomului în care există o probabilitate mai mare de a găsi un electron.
Pentru a cunoaște numărul de legături pe care le face un atom și pentru a înțelege fenomenul hibridizare, este necesar să cunoaștem câteva puncte fundamentale despre atom:
1O punct: energia subnivelează
Subnivelele energetice pe care le poate avea un atom sunt s, p, d, f.
2O punct: numărul de orbitali pe subnivel
Fiecare subnivel de energie are o cantitate diferită de orbitali, așa cum putem vedea mai jos:
Subnivel: 1 orbital;
p subnivel: 3 orbitali;
Subnivelul d: 5 orbitali.
Reprezentarea generică a acestor orbitali se face după cum urmează:
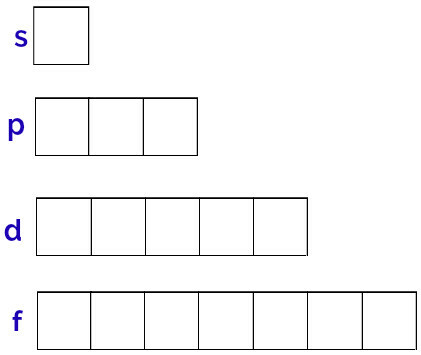
Reprezentarea orbitalilor fiecărui subnivel
Potrivit lui Pauli, un orbital poate avea maximum 2 electroni, cu rotiri (mișcări de rotație) opuse.
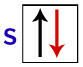
Reprezentarea orbitalului s cu electronii săi
Potrivit lui Hund, un orbital al unui subnivel primește al doilea său electron doar atunci când toți ceilalți orbitali ai acelui subnivel au primit deja primul electron.
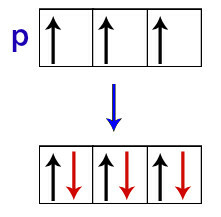
Distribuția electronilor în orbitalii p subnivel
3O punct: distribuție electronică
Pentru a înțelege hibridizarea și numărul de legături pe care le face un atom, este esențial să se realizeze distribuție eletronică pe diagrama Linus Pauling.

Diagrama Linus Pauling
Amintindu-ne că numărul maxim de electroni din fiecare subnivel este:
s = 2 electroni;
p = 6 electroni;
d = 10 electroni;
f = 14 electroni.
După această scurtă revizuire, putem defini acum ce este hibridizarea. Pentru aceasta, vom folosi elementul chimic bor (numar atomic = 5) ca exemplu.
Când efectuăm distribuția electronică a borului, avem:
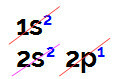
Distribuția electronică a borului în diagrama Linus Pauling
Este posibil să observăm în această distribuție că borul are 2 electroni în subnivelul și 1 electron în subnivelul p al stratul de valență.
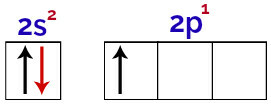
Electroni din orbitalii stratului de valență al borului
Deoarece borul are 1 orbital incomplet, prin urmare ar trebui să facă o singură legătură covalentă, deoarece numărul de legături este întotdeauna direct legat de numărul de orbitali incompleti.
Astfel, atunci când atomul de bor primește energie din mediul extern, electronii săi, în special cei din învelișul de valență, devin excitați. Acest lucru face ca unul dintre electronii orbitalului să părăsească și să ocupe unul dintre orbitalii p goi, rezultând astfel 3 orbitali atomici incompleti, după cum puteți vedea în următoarea imagine:

Reprezentarea stării excitate a atomului de bor
În cele din urmă, există uniunea orbitalului incomplet cu orbitalele p incomplete. Această unire se numește hibridizare. Deoarece avem fuziunea unui orbital s cu două p, se numește hibridizare sp2.
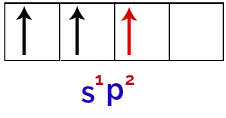
Reprezentarea orbitalilor hibridizați în atomul de bor
În plus față de bor, alte câteva elemente chimice suferă fenomenul de hibridizare, cum ar fi sulful (S), Xenonul (Xe), fosfor (P), carbon (Ç), beriliu (Fi).
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm
