O raza atomica (r) este de obicei definit ca jumătate din distanța dintre doi nuclei de atomi vecini, așa cum figura de mai jos reprezintă:

raza atomică
Raza atomică diferă de la un atom la altul în funcție de familia și perioada sa din Tabelul periodic. În ceea ce privește elementele aparținând unei aceeași familie, raza sa atomică crește odată cu creșterea numărului atomic., adică de sus în jos. Căci, în acest sens, înseamnă că de la un atom la altul a crescut un nivel de energie sau un strat electronic, astfel încât raza sa crește proporțional.
În ceea ce privește elementul în aceeași perioadă, adică pe orizontală, raza crește de la dreapta la stânga sau pe măsură ce numărul atomic scade. Acest lucru se datorează faptului că toate au același număr de straturi, ceea ce face diferența este cantitatea de electroni din aceste straturi și cu cât mai mulți electroni, cu atât este mai mare atracția către nucleu, scăzând astfel raza atom.

Direcția de creștere a razei atomice în funcție de familie și perioadă în Tabelul periodic
Cu toate acestea, raza atomică poate varia în funcție de conexiunea realizată. Să vedem cum se întâmplă acest lucru:
*Legătură ionică: Dacă atomul formează o cation, raza atomică va scădea, deoarece pierde unul sau mai mulți electroni, nucleul va atrage electronii mai intens. Acum dacă formează un anion, adică câștigă electroni, raza atomului va crește, deoarece sarcina totală a electrosferei va fi mai mare decât sarcina totală a nucleului, scăzând atracția acestuia. Cu cât câștigați sau pierdeți mai mulți electroni, cu atât va fi mai mare variația dimensiunii fasciculului.
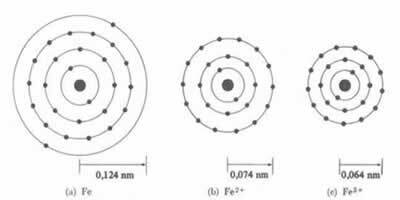
Diametrul sau raza cationului este întotdeauna mai mic decât diametrul sau raza atomului
De asemenea, într-o serie de ioni izoelectronici, care au aceeași cantitate de electroni și niveluri de energie, ionul cu cel mai mic număr atomic va avea o rază mai mare. De exemplu, ionii 13Al3+, 12mg2+, 11La1+, 9F-1, 8O2- și 7N-3, toate au 10 electroni și 2 niveluri electronice. Dar ceea ce are cea mai mare rază este 7N-3, deoarece are cel mai mic număr atomic (Z = 7).
*Legătură covalentă: Când doi atomi fac o legătură covalentă, dacă cei doi atomi sunt egali, ca în cazul hidrogenului gazos (H2), se poate vorbi de o rază covalentă (r), care este jumătate din lungimea legăturii (d), adică jumătate din distanța care separă cei doi nuclei. Cu toate că, dacă legătura este realizată de atomi diferiți, ca în cazul clorurii de hidrogen (HCl), lungimea sau distanța (d) va fi suma razelor covalente (r1 + r2) ale atomilor implicați în covalență.
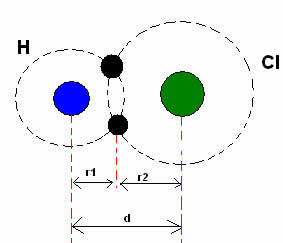
Suma razelor atomice într-o legătură covalentă.
Desigur, trebuie să ne amintim că această problemă este mult mai complicată, deoarece raza covalentă a unui atom poate varia pe măsură ce se leagă cu alți atomi diferiți.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm

