Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) a fost un chimist italian care a stabilit pentru prima dată ideea că eșantionul unui element, cu masa în grame egală numeric cu masa sa atomică, are întotdeauna același număr de atomi (N).
Avogadro însuși nu a putut determina valoarea lui N. Cu toate acestea, de-a lungul secolului al XX-lea, avansarea tehnologiei și a cunoștințelor științifice a făcut posibil ca alți oameni de știință să dezvolte tehnici care să o determine. Când această valoare a fost descoperită în cele din urmă, a fost numită Constanta lui Avogadro, în onoarea acestui om de știință, așa cum el a pus bazele creării sale.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
În 1 mol din orice entitate (atomi, molecule, electroni, formule sau ioni) este conținută exact valoarea constantei lui Avogadro.
Tabelul de mai jos prezintă câteva valori pentru constanta Avogadro obținută de-a lungul secolului XX:
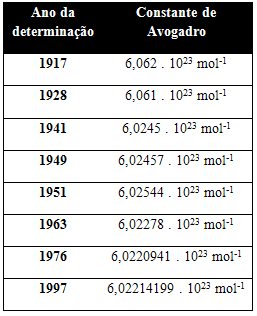
Iată câteva dintre tehnicile utilizate pentru a încerca să determine valoarea constantei lui Avogadro:
Primul om de știință care a făcut un calcul aproximativ pentru constanta lui Avogadro a fost Johann Joseph Loschmidt. În anul 1867, el s-a bazat pe teoria cinetică a gazelor și a determinat câte molecule existau în 1 cm3 a unui gaz.
Un alt dintre acești oameni de știință a fost francezul Jean Baptiste Perrin (1870-1942) care a numărat numărul de particule coloidale pe unitate de volum într-o suspensie și le-a măsurat masele. Valoarea pe care a găsit-o a fost între 6,5 și 7,2. 1023 entități per mol. Acest om de știință a publicat, în 1913, cartea Les Atomes (Prima ed. Paris: Alcan), și cea de-a 9-a ediție, publicată în 1924, conținea 16 moduri de a obține experimental constanta lui Avogadro.

Jean Baptiste Perrin (1870-1942)
Ani mai târziu, omul de știință James Dewar (1842-1923) a folosit o metodă dezvoltată cu ani mai devreme de radiochimistul Bertram Boltwood (1870-1927) și fizicianul Ernest Rutherford (1871-1937), care a constat în principiu în numărarea particulelor alfa emise de o sursă radioactivă și determinarea volumului de gaz de heliu obținut. Valoarea găsită de Dewar a fost 6,04. 1023 mol-1.
În secolul al XX-lea, Robert Millikan (1868-1953) a efectuat un experiment pentru a determina sarcina electronului (1.6. 10-19 Ç). Deoarece sarcina a 1 mol de electroni era deja cunoscută (96500 C), a fost posibil să relaționăm aceste două valori și să găsim următoarea valoare pentru constanta lui Avogadro: 6,03. 1023 mol-1.
În prezent, valoarea recomandată pentru constanta Avogadro este 6,02214 x 1023 mol-1 și se determină prin difracție de raze X, în care se obține volumul câtorva atomi ai unei rețele cristaline, atâta timp cât se cunoaște densitatea și masa a 1 mol de atomi din probă.
În scopuri didactice, în liceu, unde calculele nu trebuie să fie la fel de exacte ca cele efectuate în laboratoarele chimice, constanta lui Avogadro este considerată ca 6,02. 1023 mol-1.
Există, de asemenea, metode mai simple care pot fi utilizate pentru a ajuta elevii să determine constanta lui Avogadro în practică. Una dintre ele este prin electroliză într-un mediu apos.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm

