Reacții de deplasare, numit si reacții de substituțiesau încă din schimb simplu, sunt cele care apar atunci când o substanță simplă (formată dintr-un singur element) reacționează cu o substanță compusă, „deplasând-o” pe aceasta din urmă într-o nouă substanță simplă.
În mod generic, îl putem defini astfel:
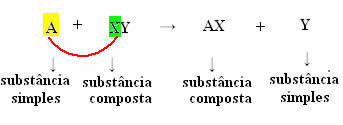
Dar pentru ca acest lucru să se întâmple, substanța simplă, în cazul simbolizat cu A, trebuie să fie mai reactiv decât elementul care va fi deplasat din compus, transformându-se într-o nouă substanță simplă (Y).
Să vedem un exemplu în care apare această reacție:
Observați experimentul de mai jos în care o placă de zinc (Zn) este plasată într-o soluție apoasă de sulfat de cupru (CuSO4). În timp, se remarcă faptul că soluția de sulfat de cupru se schimbă de la o culoare albastră la un albastru mai puțin intens, deoarece s-a decolorat și a existat un depozit de cupru pe foaia de zinc.

Putem reprezenta această reacție folosind următoarea ecuație chimică:

Rețineți că zincul a deplasat cuprul, ceea ce înseamnă că zincul este cel mai reactiv.
Deoarece ambele sunt metale, putem verifica dacă reacția de schimb simplă va avea loc sau nu, analizând coadă de reactivitate metalică prezentat mai jos:

Rețineți că cuprul este de fapt mai puțin reactiv decât zincul, deci dacă am decis să facem opusul experimentului anterior și puneți o foaie de cupru într-o soluție de sulfat de zinc, reacția nu va avea loc, deoarece cuprul nu ar putea să deplaseze zinc.
Reacțiile de deplasare sunt un tip de reacție redox, deoarece există un transfer de electroni de la substanța simplă la compozit. În procesul explicat mai sus, zincul a fost inițial în forma sa neutră, care este metalică și a devenit parte a unui compus în care are o sarcină de 2+, adică fiecare atom de zinc a pierdut doi electroni. Cu cuprul, se întâmplă opusul, acesta primește doi electroni pentru a trece la starea solidă metalică.
În cazul unei simple reacții de schimb cu nemetalele, se are în vedere: reacția va avea loc numai dacă cel mai reactiv nemetal este substanța simplă care poate deplasa un alt nemetal mai puțin reactiv. Reactivitatea ametalelor este prezentată mai jos:

De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm

