elementul chimic fosfor (P) aparține celei de-a treia perioade a Tabelului Periodic și familiei Azotului (VA). Din acest motiv, atomii săi fac în mod normal trei legături chimice a ajunge la teoria octetului (stabilitate). Cu toate acestea, există unele situații în care un atom de fosfor face mai mult de trei legături, fapt care este posibil doar prin intermediul fenomen de hibridizare.
Pentru a înțelege hibridizarea fosforului, mai întâi trebuie să înțelegem de ce atomul acestui element face trei legături. Pentru a face acest lucru, trebuie doar să vă monitorizăm distribuția electronică:

Distribuția electronică a fosforului
Putem observa că, în stratul de valență, atomul de fosfor are subnivelul 3s complet (cu doi electroni) și subnivelul 3p incomplet (fiecare dintre cei trei p subnivel orbitali are o electron). Mai jos avem distribuția electronilor în orbitalele subnivelelor Stratul de valență al fosforului:
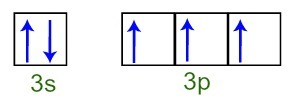
Reprezentarea electronilor învelișului de valență al atomului de fosfor
Deoarece fiecare dintre orbitalii subnivel 3p este incompletă, atomul de fosfor este capabil să facă trei legături chimice, obținând astfel stabilitate.
Acum, când ne uităm la substanța PCl5, de exemplu, suntem siguri că, în această moleculă, fosforul a suferit hibridizare, deoarece a făcut cinci conexiuni. Deoarece clorul, care aparține familiei VIIA, are nevoie de o legătură pentru a fi stabil și molecula are cinci atomi din aceasta element, fiecare dintre ei trebuie să facă o legătură, ceea ce face ca atomul de fosfor, la rândul său, să facă și cinci Conexiuni. Această apariție este posibilă numai prin intermediul hibridizarea (uniunea orbitelor atomice incomplete) a fosforului.
Când primesc energie din mediul extern, electronii atomului de fosfor devin excitați. Curând după aceea, unul dintre cei doi electroni aparținând subnivelului 3 se deplasează către un orbital gol prezent în subnivelul d, care până atunci nu are electroni. Vezi diagrama de mai jos:
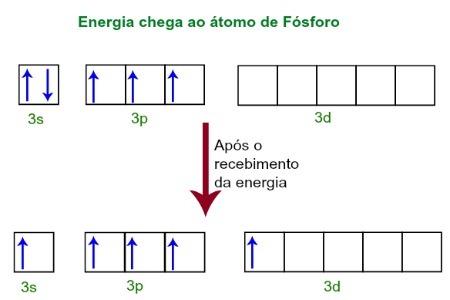
La primirea energiei, electronii fosforului sunt excitați și unul ocupă un orbital al subnivelului d.
În acest moment, avem în stratul de valență al fosforului un orbital s, trei orbitali p și un orbital incomplet.În cele din urmă, acești cinci orbitali hibridizează, adică se îmbină, rezultând cinci orbitați atomici incompleti, care sunt acum capabili să facă cinci legături chimice.

Hibridizarea orbitelor atomice incomplete ale fosforului
Ca orbital s, s-au unit trei orbitali p și un orbital d, hibridizarea fosforului este de tipul sp3d.
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm
