Dacă ar fi posibil să vizualizăm foarte clar structura unui metal, am vedea-o ca în imaginea de mai sus. Structura atomică a metalelor este cristalină, care constă din cationi metalici înconjurați de electroni.
Rețelele cristaline prezente în metale pot fi reprezentate după cum urmează: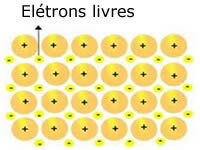
Reprezentarea sodiului metalic (Na)
Rețelele cristaline ale metalelor sunt formate dintr-un grup de cationi fixi.
Fiecare cation Na + este înconjurat de electroni, dar aceștia sunt delocalizați, adică nu sunt atrași de niciun nucleu.
Deoarece nu există nicio atracție între sarcinile negative (electron) și nucleul pozitiv (cation), electronii liberi ajung să ocupe întreaga rețea cristalină a metalului. Libertatea pe care o au mișcarea electronilor îi determină să formeze un nor electronic.
Capacitatea metalelor de a conduce electricitatea se explică prin prezența acestui nor. Curentul electric rezultă din contactul electronilor liberi cu alte metale.
În compoziția oricărui atom, inclusiv a metalelor precum sodiul (Na), aurul auriu, cuprul (Cu), există un strat de valență. Electronii se mișcă liber prin acest strat menținând atracția electromagnetică pentru cationi. Această proprietate structurală permite formarea de molecule metalice și, în consecință, a metalelor în sine.
De Líria Alves
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm
