La forte intermoleculare sunt forțe de atracție electrostatică a căror funcție este de a uni moleculele (compuși moleculari), menținându-le în stare solidă sau lichidă. Sunt extrem de importante, deoarece determină toate proprietățile fizice (punctul de topire, punctul de fierbere, densitatea și solubilitatea) de substanțe.
În acest text vom studia relația dintre forțele intermoleculare și punctul de fierbere al substanțelor. Inițial, să reamintim trei tipuri importante de forțe intermoleculare, care sunt:
♦ dipol dipol: este forța care apare în moleculele polare. Deoarece aceste molecule au un pol pozitiv și negativ, forța dipol-dipol se bazează pe atracția dintre capătul pozitiv al unei molecule și capătul negativ al altei. Exemple: HCI, HBr, SO2 și PH3
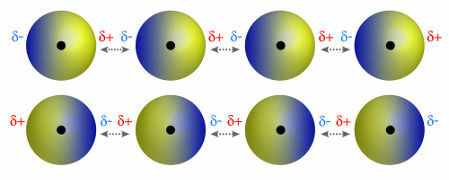
Moleculele care au un pol pozitiv și negativ care se atrag reciproc
♦ Dipol indus: este forța intermoleculară care apare numai în moleculele nepolare (nu au poli). Când două molecule apolare se apropie, are loc o deformare momentană a norilor lor electroni, care provoacă un dezechilibru în electronii moleculei, care sunt distribuiți într-un diferit pentru ea. În acel moment, se creează un dipol momentan, iar molecula are momentan un pol pozitiv și negativ, care provoacă atracția. Exemple: CO
2, CH4 și BH3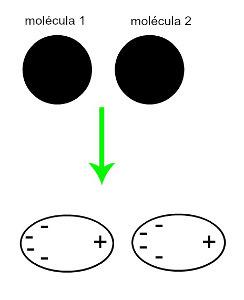
Aproximarea a două molecule nepolare generează o deformare și, în consecință, o redistribuire a electronilor, care formează dipolii momentani
♦ Legături de hidrogen: este forța intermoleculară care apare în moleculele polare, dar numai în cele care au în mod obligatoriu atomi de hidrogen legați direct cu atomi de fluor, oxigen sau azot. Poate fi considerată o forță dipol-dipol, dar de intensitate mult mai mare. Interacțiunea are loc întotdeauna între hidrogenul unei molecule și diferitul atom (F, O, N) al altei molecule. Exemple: H2O, NH3 și HF
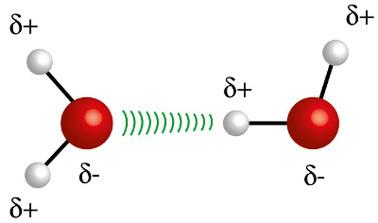
Atomul de hidrogen (sfera albă) al unei molecule interacționează cu oxigenul (sfera roșie) a altei molecule de apă
Amintindu-ne de cele trei forțe intermoleculare, le putem raporta acum la punctul de fierbere al substanțelor. se numește Punct de fierbere temperatura la care moleculele unei substanțe date încetează să mai fie în stare lichidă (au forțele lor intermoleculare rupte) și trec la o stare gazoasă. Detaliul interesant este că forțele intermoleculare și punctul de fierbere substanțelor au o relație foarte intensă și directă, deoarece cu cât forța intermoleculară este mai intensă, cu atât este mai mare punctul de fierbere. Ordinea intensității forțelor intermoleculare este:
Dipol indus
Astfel, putem concluziona că moleculele care au legături de hidrogen ca forță de interacțiune au puncte de fierbere mai mari decât cele care au dipol-dipol și așa mai departe. Tabelul de mai jos prezintă trei substanțe și valorile punctului lor de fierbere:
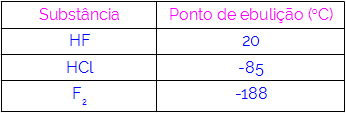
Observăm în tabel că HF are un punct de fierbere mai mare, deoarece moleculele sale sunt unite prin legături de hidrogen. Substanța F2 are cel mai scăzut punct de fierbere, deoarece moleculele sale sunt atrase de un dipol indus.
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm
