La familiile tabelului periodic sunt secvențele verticale ale tabelului și se adună elemente chimice cu proprietăți chimice similare. Astfel de asemănări se datorează prezenței unor cantități egale de electroni de valență pentru elementele grupate în aceeași familie. Familiile găzduiesc elementele reprezentative în grupele 1 și 2, de la 13 la 18 și elementele de tranziție în grupele 1 la 12.
Citeste si:Elemente transuranice - elementele chimice create de om care vin după uraniu în Tabelul Periodic
Subiectele acestui articol
- 1 - Rezumatul familiilor Tabelului Periodic
- 2 - Organizarea familiilor Tabelului Periodic
-
3 - Nomenclatorul familiilor Tabelului Periodic
- → Elemente reprezentative ale Tabelului Periodic
- → Elemente de tranziție ale tabelului periodic
- 4 - Elemente chimice ale familiilor Tabelului Periodic
-
5 - Principalele caracteristici ale familiilor Tabelului Periodic
- → Grupa 1 sau familia de metale alcaline
- → Grupa 2 sau familia de metale alcalino-pământoase
- → Grupele 3 până la 12 sau familia de metale tranziționale
- → Grupa 13 sau familia borului
- → Grupa 14 sau familia carbonului
- → Grupa 15 sau familia azotului
- → Grupa 16 sau familia oxigenului (calcogeni)
- → Grupa 17 sau familia de halogeni
- → Grupa 18 sau familia gazelor nobile
-
6 - Tabel periodic și distribuție electronică
- → Distribuirea electronică a elementelor reprezentative
- → Distribuția electronică a elementelor de tranziție
- 7 - Exerciții rezolvate pe familiile Tabelului periodic
Rezumatul familiilor tabelului periodic
Familiile corespund liniilor verticale ale Tabelul periodic.
Cunoscute și sub denumirea de grupuri, familiile din Tabelul Periodic sunt numerotate de la 1 la 18.
Elementele chimice din aceeași familie au proprietăți chimice similare.
Familiaritatea unui set de elemente se explică prin a avea un număr egal de electroni de valență.
Elementele reprezentative sunt împărțite în grupele 1, 2, 13, 14, 15, 16, 17 și 18. Fiecare dintre aceste familii are nume specifice.
Elementele de tranziție formează o singură familie care este împărțită în grupurile 3, 4, 5, 6, 7, 8, 9, 10, 11 și 12.
Nu te opri acum... Mai sunt dupa publicitate ;)
Organizarea familiilor Tabelului Periodic
Familiile în tabelul periodic sunt secvențele verticale ale tabelului, adică coloanele. Cunoscute și sub denumirea de grupuri, familiile Tabelului Periodic sunt numerotate de la 1 la 18, de la stânga la dreapta.
Elementele chimice care ocupă aceeași coloană sunt considerate a fi din aceeași familie., datorită asemănării dintre proprietățile lor chimice, care se datorează faptului că au același număr de electroni la coajă de valență. De exemplu, toate elementele chimice din familia 18 au opt electroni în învelișul de valență (înveliș complet) și rareori participă la legături chimice.
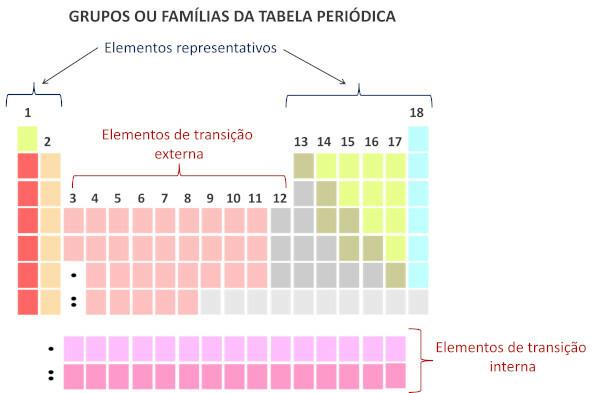
Conform sistemului modern de Uniunea Internațională de Chimie Pură și Aplicată (Iupac), fiecare grup sau familie este identificat printr-un număr de la 1 la 18, începând de la stânga la dreapta în Tabelul Periodic.
Este important de subliniat faptul că vechiul sistem IUPAC a adoptat un sistem alfanumeric, cu literele A și B pentru a se referi la elementele reprezentative și respectiv de tranziție. În prezent, acest tip de nomenclatură nu mai este utilizat.
Nomenclatura familiilor Tabelului Periodic
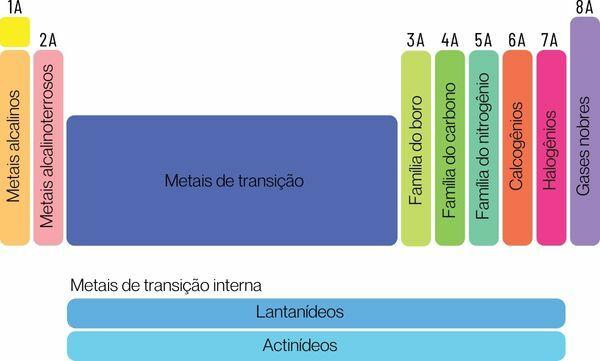
Elementele chimice pot fi clasificate în două mari familii: elemente reprezentative și elemente de tranziție.
→ Elemente reprezentative ale Tabelului Periodic
Elementele reprezentative sunt împărțite în grupele 1, 2, 13, 14, 15, 16, 17 și 18. Fiecare dintre aceste grupuri are un nume specific, prin care poate fi cunoscut și. Uite:
Grupa 1: familie de metale alcalin.
Grupa 2: familie de metale alcalino-pământoase.
Grupa 13: familia de bor sau metal pământ.
Grupa 14: familia carbonului.
Grupa 15: Familia de azot sau de Pnicogeni.
Grupa 16: familia oxigenului sau calcogenului.
Grupa 17: familie de halogeni.
Grupa 18: familie de gaze nobile.
→ Elemente de tranziție ale tabelului periodic
Tu elemente de tranzițieformați o singură familie împărțită în grupurile 3, 4, 5, 6, 7, 8, 9, 10, 11 și 12. Serii de lantanide și actinide fac, de asemenea, parte din elementele de tranziție.
Elementele de tranziție sunt toate metalice și au proprietăți chimice similare, chiar având electroni diferiți în învelișul de valență și, prin urmare, ar forma o singură și mare familie de metale de tranziție.
Elemente chimice din familiile Tabelului Periodic
Fiecare familie sau grup este compus dintr-un set de elemente chimice. Vezi descrierea elementelor chimice care alcătuiesc fiecare familie:
Grupa 1:litiu, sodiu, potasiu, rubidiu, cesiu, franciu.
Grupa 2:beriliu, magneziu, calciu, stronţiu, bariu, radio.
Grupa 3:scandiu, ytriu, seria lantanidelor și seria actinidelor.
Grupa 4: titan, zirconiuO, hafniu Este rutherfordiu.
Grupa 5:vanadiu, niobiu, tantal Este dubniu.
Grupa 6:crom, molibden, tungsten Este seaborgiu.
Grupa 7:mangan, tehnețiu, reniu Este bohrio.
Grupa 8: fier, ruteniu, osmiu Este hassium.
Grupa 9:cobalt, rodiu, iridiu și meitnerium.
Grupa 10:nichel, paladiu, platină și darmstadtio.
Grupa 11: cupru, argint, aur și roentgeniu.
Grupa 12:zinc, cadmiu, Mercur și Copernic.
Grupa 13: bor, aluminiu, galiu, indiu și taliu.
Grupa 14: carbon, siliciu, germaniu, staniu, conduce și flerovium.
Grupa 15:azot, fosfor, arsenic, antimoniu Este bismut.
Grupa 16:oxigen, sulf, seleniu, teluriu, poloniu și livermorium.
Grupa 17: fluor, clor, brom, iod si astatin.
Grupa 18:heliu, neon, argon, cripton, xenon Este radon.
Important: elementul chimic hidrogen este un caz particular, deoarece, în ciuda faptului că este situat lângă grupul 1, nu face parte din familia metalelor alcaline, deoarece nu are proprietăți chimice similare.
Aflați mai multe: Care sunt elementele radioactive din Tabelul Periodic?
Principalele caracteristici ale familiilor Tabelului Periodic
Sunt solide metalice, strălucitoare și netede.
Au conductivitate termică ridicată și ridicată Conductivitate electrică.
avea temperaturile topire relativ scăzută.
Sunt foarte reactivi cu apă.
Tendința de a forma cationi monovalenți (sarcină +1).
Sunt solide metalice, strălucitoare și mai dure în comparație cu metalele alcaline.
Se oxidează ușor.
Au o conductivitate termică ridicată și o conductivitate electrică ridicată.
Au temperaturi de topire puțin mai mari în comparație cu metalele alcaline.
Sunt reactive cu apa.
Tendința de a forma cationi divalenți (sarcină +2).
Ei sunt cea mai mare familie din Tabelul Periodic.
Solide metalice dure, strălucitoare.
Au o conductivitate termică ridicată și o conductivitate electrică ridicată.
Dens.
Temperaturi ridicate de topire.
pot prezenta diferite stări de oxidare.
→ Grupa 13 sau familia borului
Au proprietăți intermediare între proprietățile metalelor și nu metale.
Sunt solide în condiții ambientale.
Tendința de a forma cationi trivalenți (sarcină +3).
→ Grupa 14 sau familia carbonului
Au proprietăți intermediare între proprietățile metalelor și nemetalelor.
Sunt solide în condiții ambientale.
Tendința de a forma patru legături.
Sunt solide în condiții ambientale.
Carbonul și siliciul pot forma legături în lanț.
→ Grupa 15 sau familia azotului
Au proprietăți intermediare între proprietățile metalelor și nemetalelor.
Solide în condiții ambientale, cu excepția azotului, care este un gaz.
Azotul și fosforul sunt fundamentale în organismele vii.
Arsenicul este foarte toxic.
→ Grupa 16 sau familia oxigenului (calcogeni)
Au proprietăți diferite, trecând de la un element nemetalic la un element metalic pe măsură ce mergeți în familie.
Solide în condiții ambientale, cu excepția oxigenului, care este un gaz.
Tendința de a forma anioni divalenți (sarcina -2).
→ Grupa 17 sau familia de halogeni
Sunt nemetale.
Destul de reactiv.
Conductoare termice și electrice proaste.
În condiții ambientale, fluorul și clorul există ca gazele, bromul este lichid, iar iodul este solid.
Tendința de a forma anioni monovalenți (sarcina -1).
→ Grupa 18 sau familia gazelor nobile
Sunt nemetale.
Foarte puțin reactive, deci pot fi numite gaze inerte.
Ele există sub formă de gaze.
Nu au tendinta de a se forma ionii.
Tabel periodic și distribuție electronică
Elementele chimice aparținând aceleiași familii sau grupe au proprietăți chimice similare deoarece au număr egal de electroni în învelișul de valență.
Numărul de electroni din învelișul de valență este relevant, deoarece determină tendința de formare a cationilor sau anionii, tipul de legătură chimică care trebuie formată, energia implicată în reacțiile chimice, printre altele caracteristici. Pentru a afla numărul de electroni de valență, este necesar să se cunoască numar atomic a elementului și efectuați dvs distributie electronica.
→ Distribuirea electronică a elementelor reprezentative
Elementele reprezentative au cei mai energici electroni ai lor în subniveluri s Este P a stratului electronic (n). Următorul tabel reunește configurațiile electronice asociate fiecărei familii de elemente reprezentative. termenul n variază de la 1 la 7 și reprezintă nivelul energetic ocupat de electronii de valență, echivalent cu perioada (linia orizontală) din Tabelul periodic în care se găsește elementul.
Distribuirea electronică a elementelor reprezentative | ||
familie sau grup |
Distributie electronica |
Exemplu |
1 |
S.U.A1 |
Li (Z=3): 1s2 2s1 |
2 |
S.U.A2 |
Fi (Z=4): 1s2 2s2 |
13 |
S.U.A2 np1 |
B (Z=5): 1s2 2s22p1 |
14 |
S.U.A2 np2 |
C (Z=6): 1s2 2s22p2 |
15 |
S.U.A2 np3 |
N (Z=7): 1s2 2s22p3 |
16 |
S.U.A2 np4 |
O (Z=8): 1s2 2s22p4 |
17 |
S.U.A2 np5 |
F (Z=9): 1s2 2s22p5 |
18 |
S.U.A2 np6 |
Ne (Z=10): 1s2 2s22p6 |
→ Distribuția electronică a elementelor de tranziție
Elementele de tranziție sunt repartizate între grupele 3 și 12 și au subnivelurile d Este f ocupat de electroni de valență:
Elemente de tranziție externe: menține electronii de valență în subnivel d, păstrând configurația electronică egală cu S.U.A2 (n-1)d(1 la 8). De exemplu, elementul nichel (Z = 28) aparține grupului 10, iar configurația sa este 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Elemente interne de tranziție: fac parte din grupa 3, dar sunt „interne” Tabelului Periodic, fiind extinse sub acesta, în perioadele 6 (lantanide) și 7 (actinide). Aceste elemente au electroni de valență care ocupă subînvelișul f și configurația electronică generală a S.U.A2 (n-2)f(1 la 13). De exemplu, elementul lantan (Z = 57) este primul element din seria lantanidelor, iar configurația sa electronică este 1s.2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Aflați și:Care este originea tabelului periodic?
Exerciții rezolvate pe familiile Tabelului periodic
intrebarea 1
(UFC — adaptat) În ceea ce privește clasificarea periodică modernă a elementelor, bifați afirmația adevărată:
A) În Tabelul Periodic, familiile sau grupurile corespund liniilor orizontale.
B) Elementele dintr-o familie au proprietăți chimice foarte diferite.
C) Într-o familie, elementele au în general același număr de electroni în ultimul înveliș.
D) Într-o perioadă, elementele au proprietăți chimice similare.
E) Elementele reprezentative sunt repartizate în grupele de la 3 la 12.
Rezoluţie:
Alternativa C
Elementul A este incorect: familiile sau grupurile sunt coloanele (liniile verticale) ale tabelului periodic.
Elementele B și D incorecte: Într-o familie, elementele au proprietăți chimice similare. În perioade, elementele au aceeași înveliș de electroni ocupat de electroni de valență.
Elementul C corect: Într-o familie, elementele au același număr de electroni în ultimul înveliș.
Elementul E incorect: elementele reprezentative sunt grupele 1, 2, 13, 14, 15, 16, 17 și 18. Elementele de tranziție sunt distribuite în grupuri de la 3 la 12.
intrebarea 2
(EAM) Elementele A, B și C au următoarele configurații de electroni în învelișul lor de valență:
A: 3s1
B: 4s2 4p4
C: 3s2
Pe baza acestor informații, selectați opțiunea corectă.
A) Elementul A este un metal alcalin.
B) Elementul B este un halogen.
C) Elementul C este un calcogen.
D) Elementele A și B aparțin celei de-a treia perioade a Tabelului Periodic.
E) Cele trei elemente aparțin aceleiași grupe a Tabelului Periodic.
Rezoluţie:
Alternativa A
Elementul A corect: elementul A are o distribuție electronică care conține doar un electron de valență, de aceea aparține grupului 1 al Tabelului Periodic.
Elementul B incorect: elementul B are o configurație electronică de 4s2 4p4, indicând faptul că în ultimul înveliș sunt 6 electroni și că acest element aparține grupului 16 (calcogeni).
Elementul C incorect: elementul C are o configurație electronică cu 2 electroni în ultimul înveliș, deci este un element din grupa 2 din tabel.
Elementul D incorect: elementul A aparține perioadei a treia (n = 3), iar elementul B aparține perioadei a patra (n = 4).
Element incorect E: cele trei elemente au cantități diferite de electroni în ultimul înveliș, deci nu pot face parte din aceeași familie.
De Ana Luiza Lorenzen Lima
Profesor de chimie
Faceți clic aici, aflați ce este un strat de valență și aflați cum poate fi identificat.
Înțelegeți cum se face distribuția electronică și consultați exemple.
Aflați despre particularitățile elementelor de tranziție internă (actinide și lantanide), care ocupă perioada a șasea și a șaptea din grupa 3 a Tabelului periodic.
Cunoaște elementele chimice existente, înțelegând ce sunt acestea și cum să le reprezinte.
Gazele nobile sunt singurele elemente găsite sub formă izolată în natură. Află mai multe despre ei aici în acest articol!
Aflați despre halogeni, proprietățile, caracteristicile și principalele lor utilizări în viața de zi cu zi.
Aflați mai multe despre metalele alcalino-pământoase, cunoașterea caracteristicilor, proprietăților și aplicațiilor.
Înțelegeți ce este numărul atomic și aflați care sunt caracteristicile atomului care pot fi determinate din acesta.
Verifica aici care este tabelul periodic si vezi un model interactiv pentru ca tu sa cunosti toate elementele chimice care il constituie.


