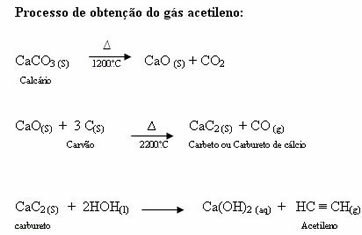
THE izomerie este un fenomen observat când diferiți compuși sunt formați din cantități egale din aceleași tipuri de atomi.
Prin urmare, putem găsi substanțe chimice cu aceeași formulă moleculară și cu formule structurale sau aranjamente spațiale diferite.
Acest fenomen este observat pe scară largă în chimia organică, care studiază compușii carbonului. Deoarece fiecare atom al acestui element poate face 4 legături chimice, este posibil să se observe diferite combinații.
Deoarece modificarea aranjamentului atomilor dă naștere la noi substanțe, în consecință, aceștia au proprietăți fizice și chimice diferite.
Când spunem ce compuși sunt izomerii înseamnă că au părți egale, deoarece cuvântul este o combinație a doi termeni de origine greacă: isos, înseamnă „cu adevărat”, și doar, care este „părți”.
Cele două grupe majore de izomerie sunt planul și spațiul (stereoizomerie).
THE izomerie plată poate fi vizualizat prin formula structurală plată a compușilor și are cinci clase: poziție, funcție, lanț, compensare și tautomerie.
THE izomerie spațială se observă prin orientarea compuşilor şi se împarte în geometrice (cis-trans) şi optice.
Conceptul de izomerism a fost introdus în 1830 de omul de știință suedez Jacob Berzelius.
Exemple de izomeri
THE izomerie de lanț apare atunci când același set de atomi se conectează pentru a forma structuri din aceeași grupă funcțională, dar cu lanțuri diferite.
Exemplu: formula moleculară C4H10 a unei hidrocarburi poate fi drept sau ramificat.

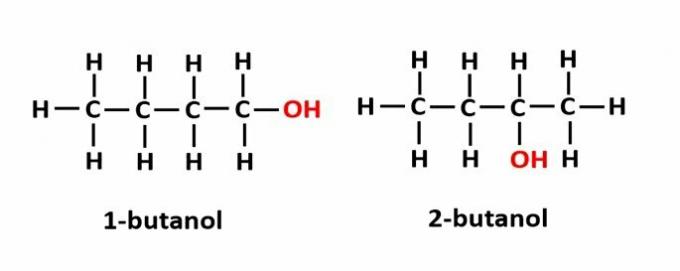
THE izomerie de poziție apare atunci când compușii sunt formați din aceleași grupări funcționale, dar se află în poziții diferite în lanț.
Exemplu: formula moleculară C4H9OH corespunde la două tipuri de alcool.
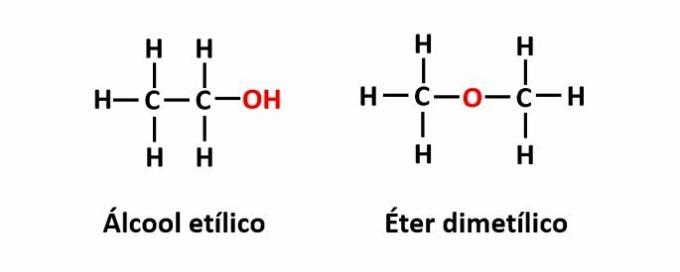
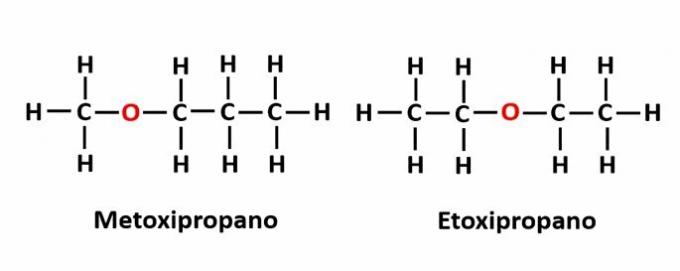
THE izomeria funcției apare atunci când aceeași formulă moleculară corespunde la doi compuși cu grupe funcționale diferite.
Exemplu: formula moleculară C2H6O corespunde la doi izomeri care au funcțiile alcool (-OH) și eter (-O-).
THE izomerie de compensare apare atunci când există un heteroatom în lanț și acesta ocupă poziții diferite. Acesta este un caz particular de izomerie de poziție.
Exemplu: formula moleculară C4H10Indică prezența unui atom de oxigen în lanț, dar poziția acestuia se poate modifica și poate forma diferiți compuși.
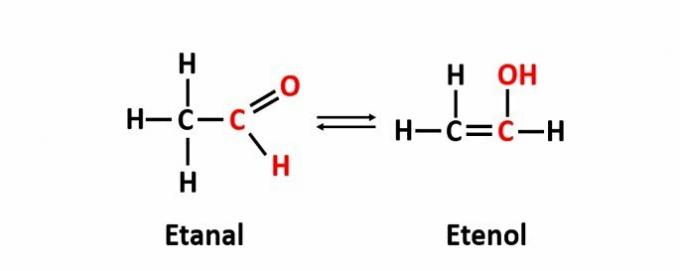
THE izomerie dinamică, numită și tautomerie, apare atunci când doi compuși cu funcții diferite se află în aceeași soluție în echilibru dinamic. Acesta este un caz particular de izomerie a funcției.
Exemplu: formula moleculară C2H4O corespunde compușilor cu funcțiile aldehidă și enol.
Află mai multe despre izomerie plată.
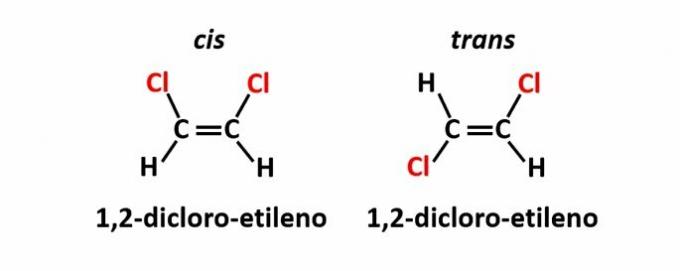
THE izomerie geometrică, numită și izomerie cis-trans, apare atunci când prezența unei duble legături sau a unei structuri ciclice face ca liganzii egali să fie pe aceeași parte a planului (cis) sau pe părți opuse (trans).
Exemplu: atomii de clor din compușii cu formula moleculară C2H2Cl2 pot avea două structuri spațiale.
THE izomerie optică apare atunci când, la devierea luminii polarizate emise pe structură, compușii reușesc să devieze fasciculul luminos la stânga, dacă este un izomer levogitor (l), sau la dreapta, când este un izomer dextrogiro (d).
Exemplu: Acest tip de izomerie apare cu acidul lactic. Rețineți mai jos că imaginile spectrale ale izomerilor nu se suprapun, de aceea se numesc enantiomeri.
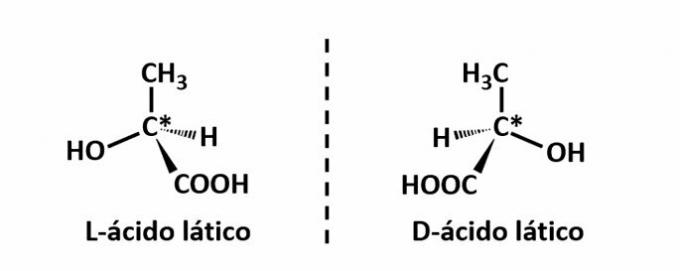
Simbolul C* indică prezența unui carbon chiral în această structură, adică un atom de carbon cu 4 linkeri diferiți.
Aflați mai multe despre izomerie cu conținutul:
- Tipuri de izomerie
- izomer spațial
- izomer geometric
- izomer optic
- Exerciții de izomerie plană