THE distilare este o metodă de separare a amestecurilor omogene, adică atunci când componentele sunt într-o singură fază.
Există două tipuri de distilare. Distilarea simplă este utilizată în separarea solid-lichid și distilarea fracționată într-un amestec de lichide care sunt miscibile între ele.
Pentru a putea izola o anumită componentă a unui amestec este necesară modificarea unei variabile. În cazul distilării, separarea are loc prin modificarea temperaturii astfel încât componenta de interes să-și schimbe starea fizică.
Proprietatea substanțelor utilizate în acest proces este Punct de fierbere, adică temperatura la care are loc trecerea de la lichid la gaz.
proces de distilare
Procesul de distilare constă în furnizarea de căldură unui amestec până când se atinge punctul de fierbere al componentului de interes și acesta trece în stare gazoasă, separându-se de celelalte.
După aceea, gazul trece printr-o coloană de răcire, unde căldura va fi îndepărtată din substanță până când ajunge la punctul de topire și, astfel, revine la starea lichidă. Acest material este direcționat către alt recipient.
distilare simplă
Pentru a separa un amestec omogen de solid dizolvat în lichid se foloseşte distilare simplă.
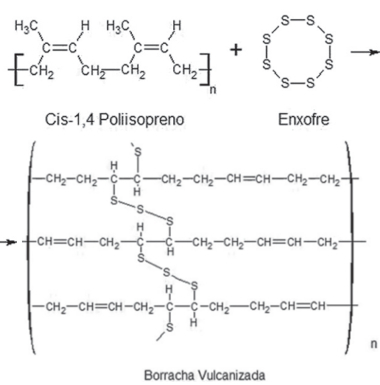
În imaginea de mai jos putem vedea echipamentele de bază pentru procesul de separare.

Sunt ei:
- Balon de distilare (1), care conține amestecul;
- Pătură de încălzire (2), care asigură căldură amestecului;
- Termometru (3), pentru a monitoriza schimbarea temperaturii;
- Condensator (4), pentru a răci componenta evaporată și
- Pahar (5), pentru a colecta componenta separată în stare lichidă.
Acest proces poate fi utilizat, de exemplu, pentru a separa clorura de sodiu (NaCl), cunoscută sub numele de sare de masă, și apă. Sarea are un punct de fierbere de 1465 °C și se dizolvă în apă pentru a forma un amestec omogen.
Deoarece apa are un punct de fierbere de 100 ºC, se schimbă cu ușurință în stare gazoasă și este separată de amestec, în timp ce sarea cristalizează și rămâne în stare solidă în recipient.
Vaporii de apă ies prin partea superioară a balonului de distilare și trec printr-un condensator. Apa rece sau rece circulă pe pereții acestui echipament. Schimbul de căldură între fluide face ca componenta separată a amestecului să piardă căldură și să revină la o stare lichidă pentru a fi colectată într-un alt recipient. Acest lichid se numește distilat.
distilație fracțională
Pentru a separa un amestec omogen de lichide miscibile între ele iar cu o mare diferență între temperaturile de fierbere se folosește distilare fracționată.
Această metodă este fracţionată deoarece componentele sunt separate de amestec în ordine crescătoare a punctului de fierbere, adică începând cu cea mai scăzută până la cea care necesită cea mai mare temperatură pentru a schimba faza.
În imaginea de mai jos, există echipamentul folosit pentru efectuarea metodei.
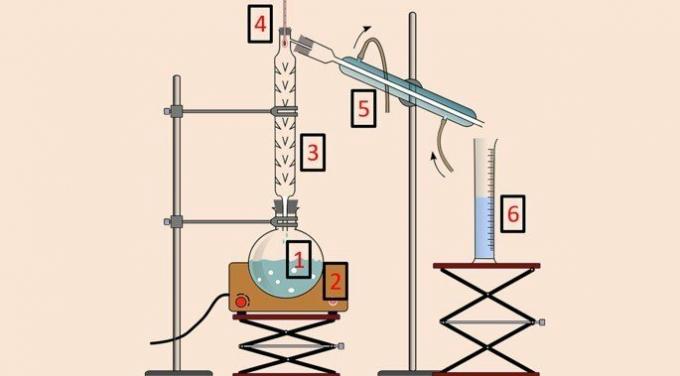
Ca și în cazul distilarii simple, se utilizează balonul de distilare (1), pătura de încălzire (2), termometrul (4), condensatorul (5) și paharul (6). Însă coloană de distilare sau fracţionare (3) este echipamentul care permite separarea în funcție de temperatură.
Coloana de distilare are în interior o serie de obstacole pentru a împiedica volatilizarea simultană a tuturor componentelor amestecului.
Acest proces este utilizat pe scară largă pentru separarea fracțiilor de petrol, care este un amestec de hidrocarburi. Unele dintre componentele petroliere și punctele de fierbere (PE) ale acestora sunt: butan (PE 20 ºC), benzină (PE 150 ºC) și kerosen (PE 300 ºC).
Prin distilare fracționată, butanul este prima componentă separată, având punctul de fierbere cel mai scăzut, apoi benzina, cu punct de fierbere intermediar și, în final, kerosenul.
Aplicații de distilare
Distilarea este utilizată pe scară largă în industrii, deoarece multe amestecuri sunt supuse acestui proces. Băuturi spirtoase precum whisky, brandy și vodca sunt preparate folosind această metodă.
Industria petrochimică folosește distilarea fracționată pentru a rafina petrolul. Turnurile de distilare sunt structuri mari realizate pentru a separa fracțiunile acestui combustibil fosil.

Exerciții de distilare
intrebarea 1
Distilarea este o metodă de separare bazată pe proprietăți.
chimia
b) Fizica
c) biologic
d) General al materiei
Alternativa: b) Fizica.
Punctul de fierbere este o proprietate fizică specifică a materiei, deoarece este inerentă unei substanțe date. Este temperatura la care un material trece de la starea lichidă la starea gazoasă, adică suferă evaporare.
intrebarea 2
Acestea sunt exemple de amestecuri separate prin distilare, CU EXCEPȚIA
a) apă + acetonă
b) saramură
c) apă + ulei
d) apa de mare
Alternativa corecta: c) apa + ulei.
Apa și uleiul sunt substanțe nemiscibile. În acest caz, pentru separarea componentelor amestecului se folosește metoda de decantare. Această metodă se bazează pe diferența de densitate.
Saramura (apă + sare) și apa de mare, care are și săruri dizolvate, se separă prin distilare simplă. Pentru apă și acetonă se folosește distilare fracționată.
intrebarea 3
(UFRGS) Un sistem eterogen bifazic este format din trei lichide diferite A, B și C. Se știe că:
A și B sunt miscibile între ele;
C este nemiscibil cu A și cu B;
A este mai volatil decât B.
Pe baza acestor informații, cele mai potrivite metode de separare a celor trei lichide sunt:
a) centrifugare şi decantare.
b) decantarea si topirea fractionata.
c) filtrare şi centrifugare.
d) filtrare şi distilare fracţionată.
e) decantare şi distilare fracţionată.
Alternativa corecta: e) decantare si distilare fractionata.
Sistemul eterogen al întrebării are două faze:
Faza 1: lichidele A și B, care sunt miscibile între ele
Faza 2: C lichid, care este nemiscibil cu celelalte componente
Prin urmare, din cauza diferenței de densitate, faza 1 este separată de faza 2 folosind metoda decantației. Datorită diferenței de temperatură de fierbere, deoarece A este mai volatil decât B, adică tinde să treacă cu ușurință în stare gazoasă, se folosește distilare fracționată.
Obține mai multe cunoștințe cu conținutul:
- Distilare simplă și fracționată
- Separarea amestecurilor
- Exerciții de separare a amestecurilor