THE solubilitatepoate fi definit ca cantitatea maximă posibilă de substanță dizolvată care poate fi dizolvată într-o anumită cantitate de solvent la o anumită temperatură.
Această cantitate maximă care poate fi dizolvată este cunoscută și ca coeficient de solubilitate sau gradul de solubilitate. Dar solubilitatea oricărei substanțe depinde, printre altele, de tipul de solvent în care este dispersat solutul.
De exemplu, NaCl (clorură de sodiu - sare de masă) este foarte solubil în apă, iar în 1 L de apă la 20ºC, putem solubiliza până la 360 de grame din această sare. Dar când solventul se transformă în benzină, în aceleași condiții de volum, temperatură și presiune, sarea nu se dizolvă.
De ce variază atât de mult solubilitatea unei substanțe de la un solvent la altul?
Unul dintre factori este polaritate a compuşilor implicaţi. În exemplul citat, avem că sarea este polară, apa este polară, iar benzina este nepolară. Sarea este formată din atomi de sodiu (Na) și clor (Cl) care se leagă prin legături ionice, în care sodiul donează cu siguranță un electron clorului, formând ioni de Na
+ şi Cl-. Deoarece acești ioni au sarcini opuse, ei atrag și țin împreună (Na+Cl-).
Acest lucru ne arată că sarea este cu adevărat polară, fiecare legătură ionică este polară, deoarece există o diferență de sarcină electrică în compus.
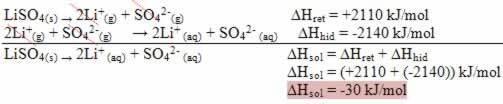
În cazul apei, legătura existentă este covalentă, în care doi atomi de hidrogen împart electroni cu un atom de oxigen. Molecula de apă are doi dipoli, oxigenul având o sarcină parțial negativă și hidrogenul având o sarcină parțial pozitivă (δ- O ─ H δ+). Dar, acești dipoli nu se anulează unul pe celălalt, deoarece molecula de apă se întâlnește la un unghi de 104,5º, arătând că distribuția și încărcarea de-a lungul moleculei nu sunt uniforme. Există o densitate de sarcină negativă mai mare pe atomul de oxigen al moleculei. Acest lucru ne arată că molecula de apă este cu adevărat polară.
Nu te opri acum... Mai sunt dupa publicitate ;)
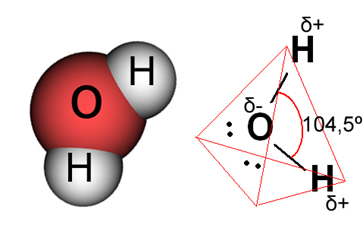
Deci, atunci când amestecăm sarea în apă, partea pozitivă a sării, care este cationii Na.+, este atras de partea negativă a apei, care este oxigenul, și de partea negativă a sării (anionii Cl-) este atrasă de partea pozitivă a apei (H+). În consecință, uniunea Na+Cl- se desface, solubilizând sarea în apă.
Benzina, pe de altă parte, este formată dintr-un amestec de diferite hidrocarburi, care sunt nepolare, adică distribuția sarcinii electrice a benzinei este uniformă. Astfel, nu există nicio interacțiune a ionilor de sare cu benzina și aceasta nu se dizolvă.
Acestea și alte cazuri similare ne conduc la următoarea concluzie:

Cu toate acestea, aceasta nu poate fi considerată o regulă generală, deoarece există multe cazuri de substanțe dizolvate nepolare care se dizolvă bine în solvenți polari și invers. Deci, pentru a înțelege de ce se întâmplă acest lucru, trebuie să luăm în considerare încă un alt factor: tipul de forta intermoleculara a solventului și a solutului.
Legea despre asta în text: „Relația dintre rezistența intermoleculară și solubilitatea substanțelor”.
De Jennifer Fogaça
Licențiat în Chimie
Doriți să faceți referire la acest text într-o lucrare școlară sau academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Relația dintre polaritatea și solubilitatea substanțelor”; Scoala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. Accesat pe 27 iulie 2021.