Oxidare este denumirea dată procesului de pierdere a electronilor de către un atom, grup sau specie ionică în timpul a reactie chimica. Se identifică din creșterea în NOX (numărul de oxidare) al speciei sau atomului când se compară reactantul și produsul.
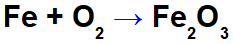
Ecuația oxidării fierului.
În ecuația de mai sus, de exemplu, putem indica NOX-ul fiecăruia dintre participanți:
Fier reactiv (Fe): are NOX 0 deoarece este a substanță simplă;
Oxigenul din reactiv (O): are NOX 0 deoarece este o substanță simplă;
Oxigen în produs: are NOX -2 deoarece nu este legat de un metal alcalin, alcalino-pământos sau formând hidrogen peroxizii sau superoxizi;
Fier în produs: are NOX +3 deoarece suma NOX de fier înmulțită cu 2 (numărul de atomi) + NOX de oxigen înmulțit cu 3 trebuie să rezulte 0 deoarece este o substanță compusă:
x.2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Comparând NOX al fierului reactiv (0) cu produsul (+3), am observat o creștere, adică a suferit procesul de oxidare. Este de remarcat faptul că apariția
oxidare este întotdeauna însoțită de fenomenul de reducere (care înseamnă câștig de electroni), identificat prin scăderea NOx, așa cum se întâmplă cu oxigenul din exemplu.Citeste si:Determinarea numărului de oxidare (NOX)
Exemple de situații în care are loc oxidarea:
1. Combustie

Arderea unui material este, de asemenea, un indiciu al oxidării.
Combustie este orice reacție chimică care are loc în prezența a combustibil oricare și oxigenul gazos oxidant (O2), rezultând producerea de căldură și lumină. În fiecare reacție de ardere are loc oxidare.
2. Unele reacții organice
În fiecare reacție organică care are loc în prezența mijloacelor enumerate mai jos, procesul de oxidare:
Bicromat de potasiu (K2Cr2O7) sau permanganat de potasiu (KMnO4);
Prezența acidului puternic sau a bazei puternice;
Ozon gazos (O3) în prezența zincului metalic (Zn) și a apei (H2O).
3. Baterii sau baterii

Bateriile sunt dispozitive în care oxidarea are loc întotdeauna.
Stive sau bateriile sunt dispozitive electrochimice care stochează substanțe chimice. Una dintre aceste substanțe va suferi oxidare, iar cealaltă va suferi o reducere, rezultând producerea de curent electric.
4. Electroliză
Electroliză este un proces chimic în care o soluție apoasă care conține o sare este supusă unui curent electric, care ajunge să favorizeze oxidarea anionilor prezenți în aceste materiale. În toată electroliză, există oxidare.
De mine. Diogo Lopes Dias
Sursă: Brazilia școală - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm


