Osmoza este mișcarea apei care are loc în interiorul celulelor printr-o membrană semipermeabilă.
În acest proces, moleculele de apă trec de la un mediu mai puțin concentrat la un mediu mai concentrat.
Prin urmare, osmoza servește la echilibrarea celor două părți ale membranei, determinând diluarea mediului bogat în solut de către solvent, care este apa.
Cum apare osmoza?
Osmoza este considerată un transport pasiv, ca și în trecerea prin membrană nu se iroseste nicio energie.
În procesul de osmoză, apa, care este solventul, tinde să traverseze membrana semipermeabilă pentru a echilibra concentrația soluției. Această acțiune se efectuează până când presiunea osmotică este stabilizată.
Prin urmare, apa se deplasează din regiunea mai puțin concentrată în cea mai concentrată, în mod natural.
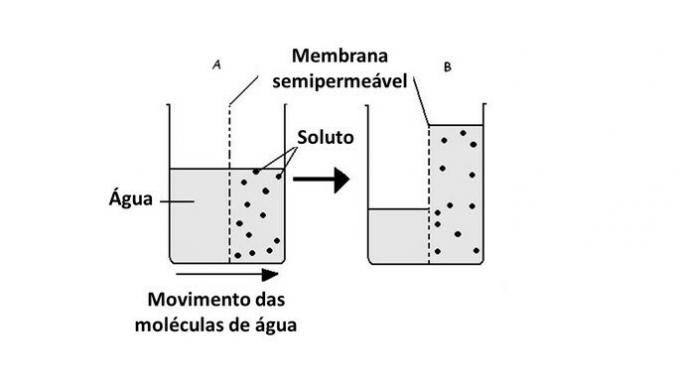
Trecerea apei de la un mediu la altul se face în celule cu ajutorul transportului proteinelor în membrană, acvaporine. Astfel, osmoza apare ori de câte ori există o diferență de concentrație între mediul extern și celulele interne.
Rezultatul osmozei este utilizat în procesele de schimb de nutrienți ale celulelor animale și vegetale.
Citește și despre Transport pasiv și Transport activ.
Soluție hipotonică, izotonică și hipertonică
După cum am văzut, procesul de osmoză are ca scop egalizarea concentrațiilor de soluții, până la atingerea unui echilibru. Pentru aceasta avem următoarele tipuri de soluții:
- soluție hipertonică: prezintă o presiune osmotică mai mare și o concentrație de solut.
- soluție hipotonică: prezintă o presiune osmotică mai mică și o concentrație de solut.
- soluție izotonică: concentrația solutului și presiunea osmotică sunt egale, ajungând astfel la echilibru.
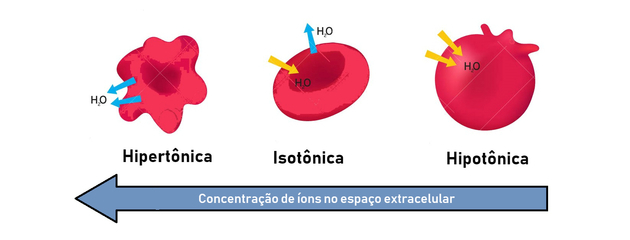
Prin urmare, osmoza apare între o cale hipertonică (mai concentrată) și hipotonică (mai puțin concentrată) de a genera un echilibru.
exemple de osmoza
În celule, membrana plasmatică este un înveliș format dintr-un strat strat lipidic, care împiedică mișcarea apei în celulă. Cu toate acestea, există proteine specializate în structura sa, acvaporine, care acționează ca canale care facilitează trecerea moleculelor de apă.
Într-un mediu hiperton, celulele tind să se micșoreze pe măsură ce pierd apă. O celulă plasată într-un mediu hipoton se poate umfla până se sparge, deoarece există mișcare de apă în celulă.
Vedeți mai jos cum apare osmoza în celulele animale și vegetale.
Osmoza în celula animală
când un celulă animală, ca și celulele roșii din sânge, sunt expuse la medii cu concentrații diferite, mișcarea apei în celulă are loc după cum urmează:
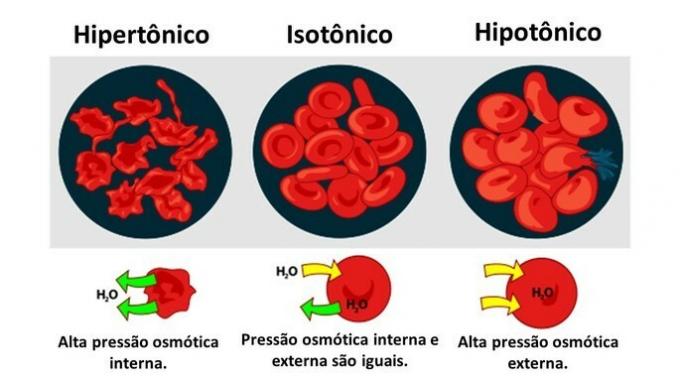
Când mediul este bogat în solut, o soluție care este hipertonică în ceea ce privește citoplasma, celulele pierd apă în mediu și se ofilesc.
Când mediul este sărac în soluție, o soluție hipotonică, moleculele de apă tind să pătrundă în celulă și, deși membrana este rezistentă, în funcție de cantitate, poate apărea perturbarea.
Osmoza celulelor vegetale
Mișcarea apei în celulele vegetale are loc între vacuolul celular și mediul extracelular.
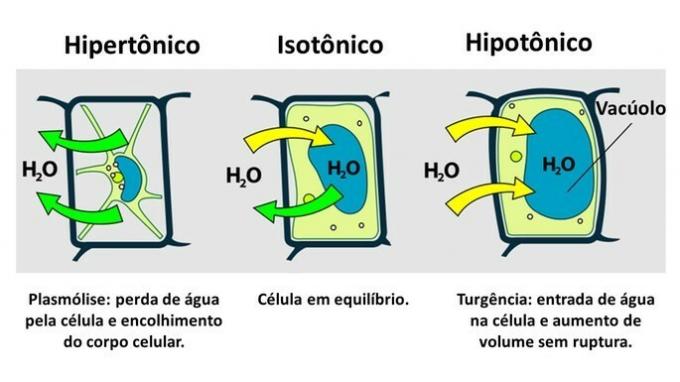
THE celula plantei are, pe lângă membrana plasmatică, un perete celular foarte rezistent, care este format din celuloză.
Prin urmare, spre deosebire de celula animală, celula vegetală rezistă la întreruperi atunci când este introdusă într-un mediu hipoton, unde apa tinde să pătrundă în celulă. Celula se umflă, mărindu-și volumul, dar peretele celular previne ruperea.
Pierderea apei de către o celulă vegetală, care este inserată într-un mediu hiperton, se numește plasmoliză. Intrarea apei în vacuol atunci când celula se află într-un mediu hipotonic se numește turgență, atunci când există o creștere a volumului celulei.
Cum influențează presiunea osmotică osmoza?
Un dizolvat este orice substanță care poate fi diluată într-un solvent, cum ar fi zahărul dizolvat în apă. În timp ce presiunea osmotică este presiunea făcută pentru ca apa să se miște.
Deoarece osmoza este un proces care apare de la cel mai puțin concentrat (hipoton) la cel mai concentrat (hiperton) căutarea echilibrului, presiunea osmotică este presiunea exercitată asupra unui sistem pentru a preveni apariția osmozei natural.
Prin urmare, cu cât diferența de concentrație dintre mediul hipertonic și cel hipotonic este mai mare, cu atât ar trebui să fie mai mare presiunea osmotică aplicată asupra soluției mai concentrate pentru a evita osmoza.
Află mai multe despre presiune osmotica.
Ce este osmoza inversă și cum funcționează
Osmoză inversă este trecerea apei în direcția opusă osmozei. Astfel, apa trece de la o soluție mai concentrată la una mai puțin concentrată.
Osmoza inversă are loc prin aplicarea unei presiuni mai mari decât presiunea osmotică naturală.
Deoarece membrana semipermeabilă permite doar trecerea solventului (apă pură), aceasta reține substanțele dizolvate.
Un exemplu de osmoză inversă este transformarea apei sărate în apă dulce prin procesul de desalinizare.
Află mai multe despre osmoza inversa.
Diferența dintre osmoză și difuzie
Difuzia este trecerea unor molecule foarte mici de gaze și substanțe dizolvate dizolvate în apă prin membrană plasmatică. În acest caz, moleculele dizolvate se vor schimba de la mediul mai concentrat la cel mai puțin concentrat. Se deplasează de-a lungul unui gradient de concentrație și se întind pe spațiul disponibil.
THE difuzarea facilitată este trecerea, prin membrană, a substanțelor care nu se dizolvă în lipide, cu ajutorul proteinelor care pătrund în stratul stratificat lipidic.
La fel ca osmoza, difuzia este, de asemenea, considerată o transport pasiv, deoarece apare în favoarea unui gradient de concentrație.
Curiozitate
Expresia „învățare prin osmoză” este utilizată pe scară largă de studenții care ar dori să învețe conținut nou fără a fi nevoie să studieze, adică fără a depune eforturi.
Citește și:
- Solut și solvent
- Pompa de sodiu și potasiu
- Permeabilitate selectivă


