Proprietățile coligative implică studii asupra proprietățile fizice ale soluțiilor, mai precis al unui solvent în prezența unui solut.
Deși nu știm, proprietățile coligative sunt utilizate pe scară largă în procesele industriale și chiar în diferite situații de zi cu zi.
Legat de aceste proprietăți sunt constante fizice, de exemplu, temperatura de fierbere sau topire a anumitor substanțe.
De exemplu, putem cita procesul industriei auto, cum ar fi adăugarea de aditivi la radiatoarele auto. Acest lucru explică de ce în locurile mai reci, apa din radiator nu îngheță.
Procesele efectuate cu alimente, cum ar fi sărarea cărnii sau chiar alimentele saturate cu zahăr, previn deteriorarea și proliferarea organismelor.
În plus, desalinizarea apei (îndepărtarea sării) precum și răspândirea sării pe zăpadă pe alocuri unde iarna este foarte dură, confirmați importanța cunoașterii efectelor coligative asupra soluții.
Doriți să aflați mai multe despre conceptele legate de proprietățile coligative? Citiți articolele:
- Stări fizice ale apei
- Punctul de topire și punctul de fierbere
- Desalinizarea apei
- Separarea amestecurilor
Solvent și soluție
În primul rând, trebuie să fim atenți la conceptele de solvent și solut, ambele componente ale unei soluții:
- Solvent: substanță care se dizolvă.
- Solut: substanță dizolvată.
De exemplu, ne putem gândi la o soluție de apă cu sare, în care apa reprezintă solventul și sarea, solutul.
Vrei să afli mai multe? Citește și tu Solubilitate.
Efecte colective: tipuri de proprietăți colective
Efectele colective sunt asociate cu fenomene care apar cu solutii și solvenții unei soluții, fiind clasificate ca:
Efect tonometric
Tonoscopia, numită și tonometrie, este un fenomen care se observă atunci când scăderea presiunii maxime de vapori a unui lichid (solvent).
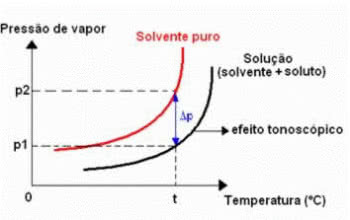
Diagrama efectului tonometric
Acest lucru se întâmplă prin dizolvarea unui dizolvat non-volatil. Prin urmare, solutul reduce capacitatea de evaporare a solventului.
Acest tip de efect coligativ poate fi calculat prin următoarea expresie:
ΔP = p0 - P
Unde,
ΔP: scăderea absolută a presiunii maxime a vaporilor la soluție
P0: presiunea maximă a vaporilor lichidului pur, la temperatura t
P: presiunea maximă de vapori a soluției, la temperatura t
Efectul Ebulliometric
Ebullioscopia, numită și ebulliometrică, este un fenomen care contribuie la creșterea variației de temperatură a unui lichid în timpul procesului de fierbere.
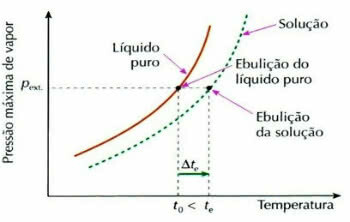
Graficul efectului ebuliometric
Acest lucru se întâmplă prin dizolvarea unui dizolvat non-volatil, de exemplu, atunci când adăugăm zahăr în apa care este pe punctul de a fierbe, temperatura de fierbere a lichidului crește.
Așa-numitul efect ebulliometric (sau ebullioscopic) este calculat prin următoarea expresie:
tși = tși - t0
Unde,
tși: creșterea temperaturii de fierbere a soluției
tși: temperatura inițială de fierbere a soluției
t0: temperatura de fierbere a lichidului pur
Efect criometric
Crioscopia, numită și criometrie, este un proces în care scăderea temperaturii de îngheța unei soluții.
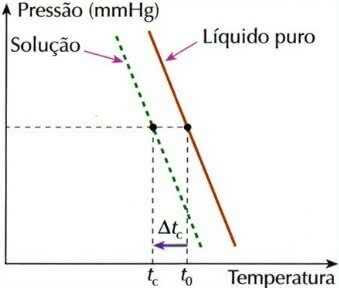
Grafic de efect criometric
Acest lucru se datorează faptului că atunci când un dizolvat non-volatil este dizolvat într-un lichid, temperatura de îngheț a lichidului scade.
Un exemplu de crioscopie îl constituie aditivii antigel care sunt plasați în radiatoarele auto în locuri unde temperatura este foarte scăzută. Acest proces previne înghețarea apei, contribuind la durata de viață utilă a motoarelor auto.
În plus, sarea răspândită pe străzi în locurile în care iarna este foarte rece, împiedică acumularea de gheață pe drumuri.
Pentru a calcula acest efect coligativ, se folosește următoarea formulă:
tç = t0 - tç
Unde,
tç: scăderea temperaturii de îngheț a soluției
t0: temperatura de congelare a solventului pur
tç: temperatura inițială de congelare a solventului în soluție
Consultați un experiment cu privire la această proprietate la: Experimente de chimie
Legea lui Raoult
Așa-numita „Legea lui Raoult” a fost propusă de chimistul francez François-Marie Raoult (1830-1901).
El a studiat efectele coligative (tonometric, ebuliometric și criometric), ajutând în studiile maselor moleculare ale substanțelor chimice.
Studiind fenomenele asociate topirii și fierberii apei, a ajuns la concluzia că: la dizolvarea a 1 mol de orice soluție nevolatilă și neionică în 1 kg de solvent, aveți întotdeauna același tonometric, ebuliometric sau criometrică.
Astfel, Legea lui Raoult poate fi exprimată după cum urmează:
“Într-o soluție solutivă nevolatilă și neionică, efectul coligativ este proporțional cu molalitatea soluției.”.
Poate fi exprimat după cum urmează:
Psoluţie = xsolvent. Psolvent pur
Citiți și despre Numărul Mol și masa molară.
osmometrie
Osmometria este un tip de proprietate coligativă care este legată de presiunea osmotică a soluțiilor.
Amintiți-vă că osmoza este un proces fizico-chimic care implică trecerea apei dintr-un mediu mai puțin concentrat (hipotonic) într-un mediu mai concentrat (hipertonic).
Acest lucru are loc printr-o membrană semipermeabilă, care permite doar trecerea apei.
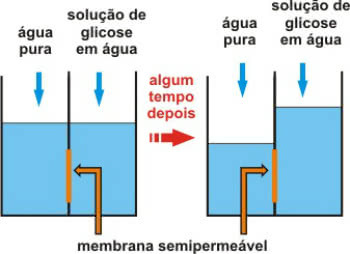
Acțiune membranară semipermeabilă după un timp
Apelul presiune osmotica presiunea este cea care permite apei să se miște. Cu alte cuvinte, presiunea exercitată asupra soluției este cea care împiedică diluarea acesteia prin trecerea solventului pur prin membrana semipermeabilă.
Prin urmare, osmometria este studiul și măsurarea presiunii osmotice în soluții.
Rețineți că în tehnica de desalinizare a apei (îndepărtarea sării) procesul denumit osmoza inversa.
Citiți mai multe despre Osmoză.
Legile osmometriei
Fizicianul și chimistul olandez Jacobus Henricus Van’t Hoff (1852-1911) a fost responsabil pentru postularea a două legi asociate osmometriei.
Prima lege poate fi exprimată după cum urmează:
“La temperatură constantă, presiunea osmotică este direct proporțională cu molaritatea soluției.”
În a doua lege postulată de el, avem următoarea afirmație:
“La molaritate constantă, presiunea osmotică este direct proporțională cu temperatura absolută a soluției.”
Prin urmare, pentru a calcula presiunea osmotică a soluțiilor moleculare și diluate, se folosește formula:
π = MRT
fiind,
π: soluție presiune osmotică (atm)
M: molaritatea soluției (mol / L)
R: constanta universală a gazelor perfecte = 0,082 atm. L / mol. K
T: temperatura absolută a soluției (K)
Citește și tu Molaritatea.
Exerciții de examen de admitere cu feedback
1. Comparând două tigăi, simultan pe două arzătoare identice pe același aragaz, se observă că presiunea de gaze din apa clocotită într-o oală sub presiune închisă este mai mare decât cea din apa clocotită într-o oală sub presiune deschis.
În această situație și dacă conțin exact aceleași cantități din toate ingredientele, putem să afirme că, în comparație cu ceea ce se întâmplă în tigaia deschisă, timpul de gătit în oala sub presiune închis va fi:
a) mai mică, deoarece temperatura de fierbere va fi mai mică.
b) mai mică, deoarece temperatura de fierbere va fi mai mare.
c) mai mică, deoarece temperatura de fierbere nu variază în funcție de presiune.
d) egală, deoarece temperatura de fierbere este independentă de presiune.
e) mai mare, deoarece presiunea va fi mai mare.
Alternativa b
2. (UFRN) În locurile severe de iarnă, este obișnuit să adăugați o anumită cantitate de etilen glicol în apa din radiatoarele auto. Utilizarea unei soluții în loc de apă ca agent de răcire se datorează faptului că soluția are:
a) căldură mai mică de fuziune.
b) punctul de îngheț inferior.
c) punctul de congelare mai mare.
d) căldură mai mare de fuziune.
Alternativa b
3. (Vunesp) Una dintre modalitățile de a vindeca rănile, conform credinței populare, este de a pune zahăr sau cafea praf pe ele. Proprietatea coligativă care explică cel mai bine îndepărtarea fluidului, prin procedura descrisă, favorizând vindecarea, este studiată de:
a) osmometrie.
b) crioscopie.
c) endoscopie.
d) tonoscopie.
e) ebulliometrie.
Alternativă la
4. (UFMG) Într-un congelator, există cinci moduri care conțin lichide diferite, pentru a face gheață și lămâie. Dacă matrițele sunt plasate în congelator în același timp și sunt inițial la aceeași temperatură, matrița care conține 500 ml de: va fi mai întâi înghețată
a) apă pură.
b) soluție, în apă, conținând 50 ml suc de lămâie.
c) soluție, în apă, conținând 100 ml suc de lămâie.
d) soluție, în apă, conținând 50 ml suc de lămâie și 50 g zahăr.
e) soluție, în apă, conținând 100 ml suc de lămâie și 50 g zahăr.
Alternativă la
5. (Cesgranrio-RJ) Punctul de topire al unei substanțe x a fost determinat, găsind o valoare mai mică decât cea tabelată pentru această substanță. Acest lucru ar putea însemna că:
a) cantitatea de substanță utilizată la determinare a fost mai mică decât este necesar.
b) cantitatea de substanță utilizată la determinare a fost mai mare decât este necesar.
c) o parte din substanță nu s-a topit.
d) substanța conține impurități.
e) substanța este pură 100%.
Alternativă


