Molecula este un set de atomi, identici sau diferiți, uniți prin legături covalente.
Aceste specii chimice sunt neutre din punct de vedere electric și reprezintă unitatea de formare a unei substanțe.
Există molecule simple precum oxigenul (O2) a aerului pe care îl respirăm. Cu toate acestea, există și compuși complecși, cum ar fi buckyballs (60 de atomi de carbon legați sub formă de sferă), care sunt cele mai mari molecule găsite vreodată în spațiu.
Studiul moleculelor
Legătura covalentă într-o moleculă corespunde împărțirii electronilor, de obicei între elemente nemetalice.
Vedeți molecula de apă ca un exemplu de compus simplu.
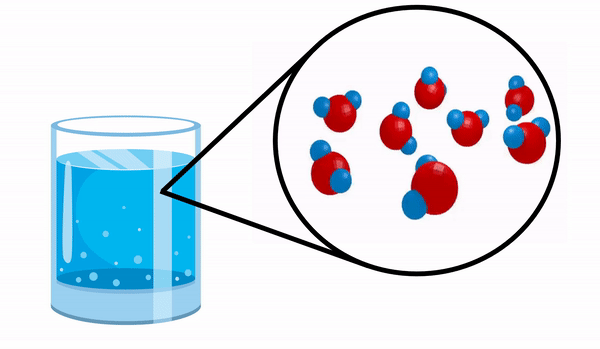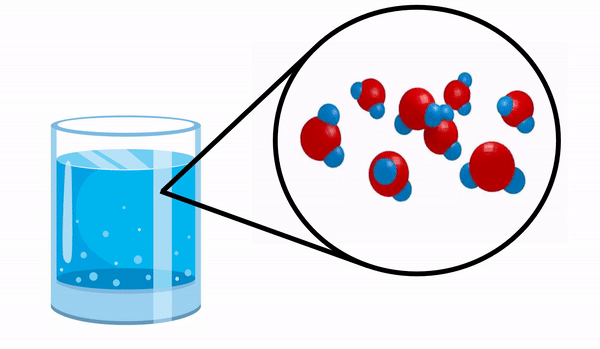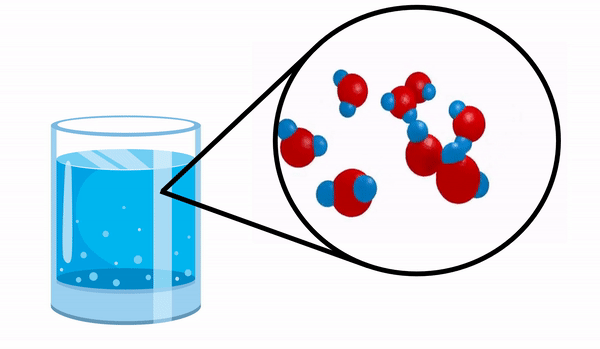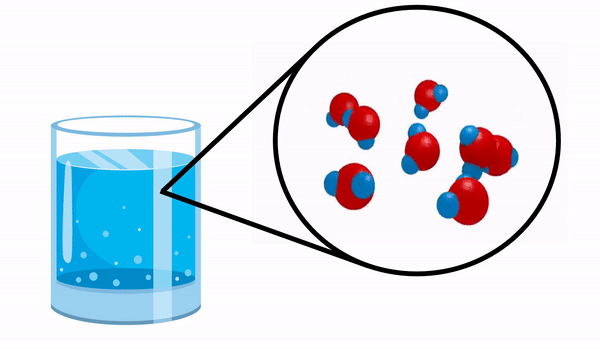
Când observăm un pahar cu Apă habar n-avem că această substanță este alcătuită din mai multe molecule de H2O. Această formulă indică faptul că apa este formată din 3 atomi: doi atomi de hidrogen și unul de oxigen, care împart electroni între ei.
Zahărul, pe care îl folosim pentru a îndulci sucurile și a face prăjituri, este, de asemenea, alcătuit din molecule. Unitatea de formare a zahărului este zaharoza.

Această moleculă este mult mai complexă, deoarece există 45 atomi conectat. Este format din: 12 atomi de carbon, 22 atomi de hidrogen și 11 atomi de oxigen.
Moleculele sunt structuri de masă moleculară cunoscută, dar există și macromolecule, care sunt „structuri gigantice” formate din atât de mulți atomi încât compoziția lor este chiar nedefinită. Un exemplu de acest tip este diamantul, o macromoleculă formată din numeroși atomi de carbon într-o rețea covalentă.
Legătură covalentă
O legătură chimică covalentă se stabilește între doi atomi atunci când aceștia împărtășesc electroni mai extern (de valență). Moleculele pot avea două tipuri de legături:
Legătură covalentă moleculară: perechea de electroni a celor doi atomi de legătură sunt împărțite.

Legătură covalentă covalentă (dativ): electronii împărțiți provin doar de la unul dintre atomii implicați.
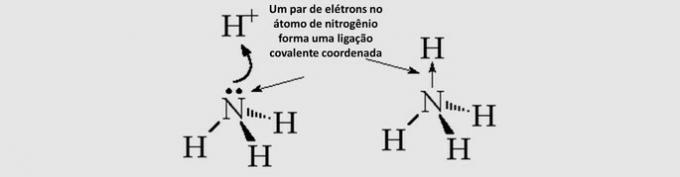
Geometrie moleculară
Când se formează o moleculă, atomii sunt poziționați în moduri diferite, astfel încât dispunerea spațială să fie mai stabilă. Prin urmare, compozitele au geometrii diferite.
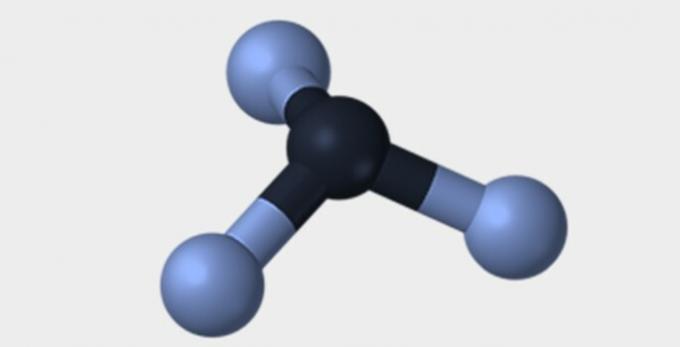
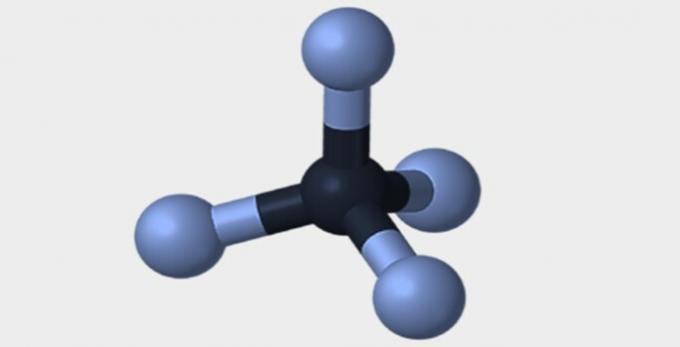
Iată câteva dintre geometriile pe care le pot avea moleculele.
| Geometrie moleculară | ||
|---|---|---|
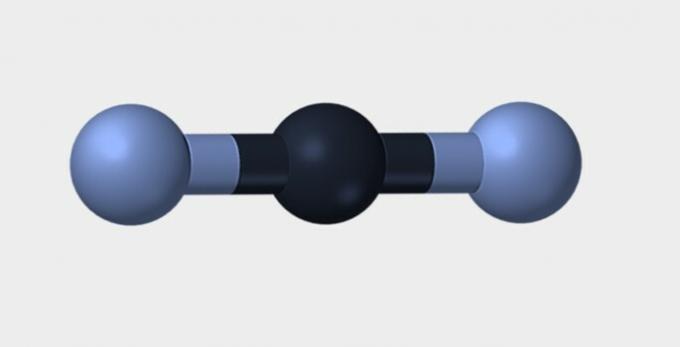
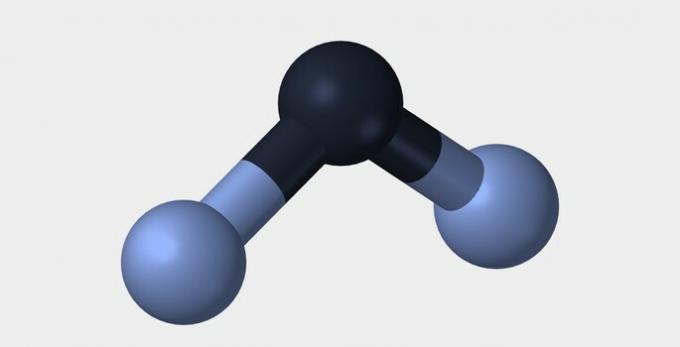
| Liniar | Unghiular | Triunghiular |
 |
 |
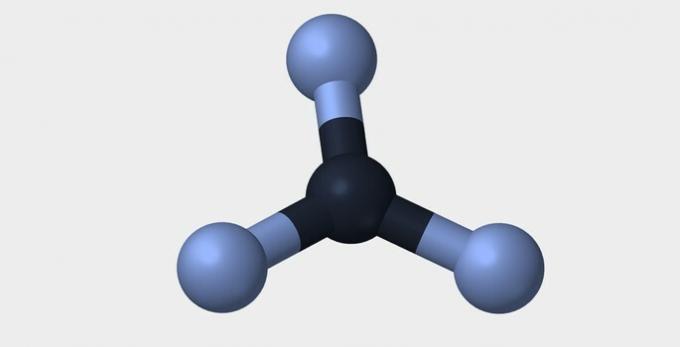 |
| Piramidal | tetraedrică | octaedrică |
 |
 |
 |
Molecule polare și nepolare
Moleculele sunt clasificate în conformitate cu polaritate.
molecule nepolare: nu există nicio diferență în electronegativitate între atomi.
| Azot (N2) | dioxid de carbon (CO2) |
|---|---|
 |
 |
Azot (N2) este o moleculă nepolară deoarece este formată de ea element chimic și, prin urmare, nu există nicio diferență în electronegativitate. dioxid de carbon (CO2) este nepolar datorită geometriei sale liniare, care stabilizează atracția oxigenului de către electroni.
molecule polare: există o diferență de electronegativitate între atomi, cu un pol pozitiv și un pol negativ.
| Apă (H2O) | Amoniac (NH3) |
|---|---|
 |
 |
În ambele exemple, vedem că atomii centrali, oxigenul și azotul, au perechi de electroni nepereche care formează nori de electroni. Deoarece există mai mulți nori electronici în jurul atomilor centrali decât există legături chimice stabilite, moleculele sunt polare.
Exemple de molecule
| Substanţă | Caracteristici | Moleculă | Formulă |
|---|---|---|---|
| Hidrogen | Combustibil și abundent în scoarța terestră. | 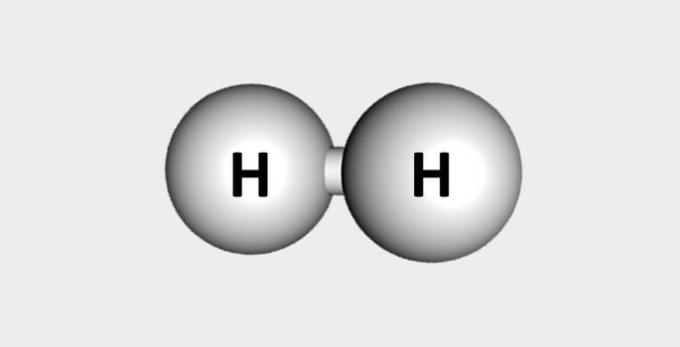 |
H2 |
| Oxigen | Esențial pentru respirație și participă la diferite reacții chimice | 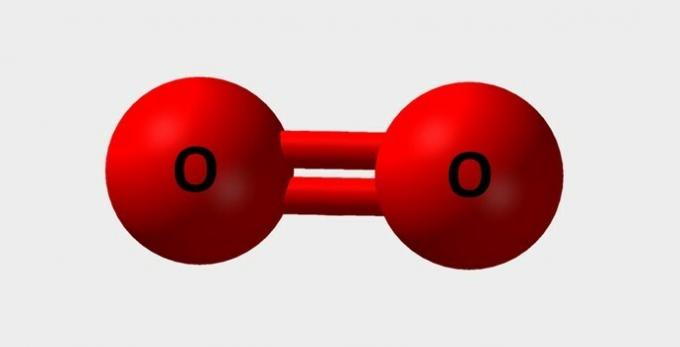 |
O2 |
| Sulf | Pulbere galbenă folosită la fabricarea coloranților. | 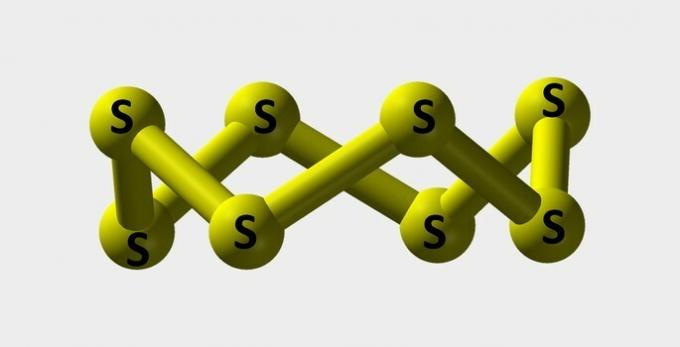 |
s8 |
| Dioxid de carbon | Utilizat în stingătoare și agenți frigorifici. | 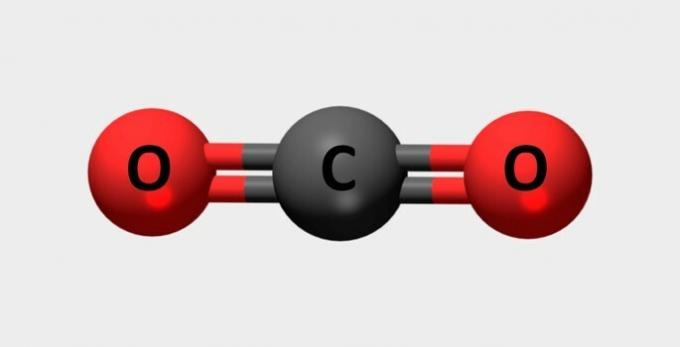 |
CO2 |
| Etanol | Alcool obișnuit folosit ca combustibil și în parfumuri. | 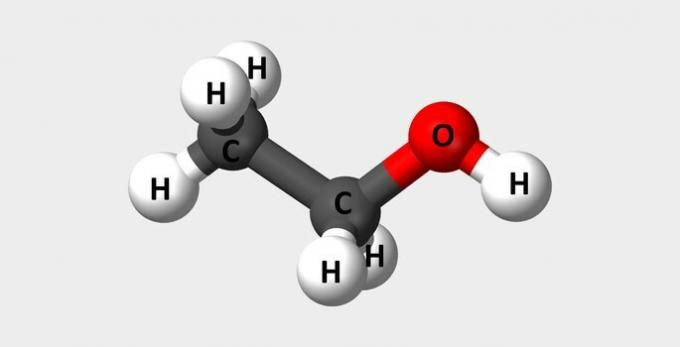 |
Ç2H6O |
Asigurați-vă că verificați aceste texte despre subiecte legate de ceea ce tocmai ați învățat:
- Biomolecule
- Compusi organici
- Masa moleculara
- Regula Octetului
- Legături chimice
- Polaritatea conexiunii
- Forte intermoleculare