Legea lui Hess a fost creată de chimistul elvețian Germain H. Hess (1802-1850), care este considerat unul dintre fondatorii termochimiei. Legea sa spunea:

Adică, ΔH depinde doar de valorile de entalpie ale reactivilor și produselor, ca în expresia:
| ΔH = ΔHreactivi + ΔHproduse |
De exemplu, luați în considerare reacția în care 1 mol de apă (H2O) se transformă în apă în stare gazoasă. Această reacție se efectuează de două ori; cu toate acestea, am ales diferite căi:
(1) A fost realizat într-un singur pas:
H2O(1) → H2O(v) ΔH = +44 kJ
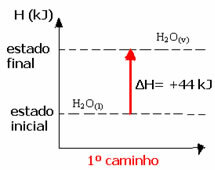
(2) A fost realizat în două etape:
Pasul 1: H2O(1) → H2 (g) + ½2 (g) ΔH = +286 kJ
Etapa a II-a: H2 (g) + ½2 (g) → H2O(v) ΔH = -242 kJ
H2O(1) → H2O(v) ΔH = +44 kJ
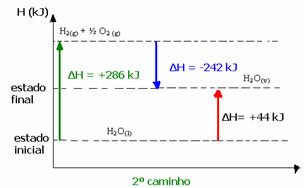
Rețineți că, indiferent dacă s-au efectuat unul sau doi pași, modificarea entalpiei (ΔH) este întotdeauna de 44 kJ. Acest lucru se datorează faptului că ΔH este suma algebrică a valorilor ΔH ale etapelor care alcătuiesc procesul, adică al proceselor intermediare:
| ΔH = ΔH1 + ΔH2 + ΔH3 + ... |
De exemplu, în al doilea caz, ΔH total al reacției a fost suma lui ΔH din prima etapă (ΔH = +286 kJ) cu cea a celui de-al doilea (ΔH = -242 kJ). Astfel, am obținut aceeași valoare de reacție cu un singur pas:
ΔH = (+286 + (-242)) kJ
ΔH = (+286 -242) kJ
ΔH = +44 kJ
Prin urmare, ne interesează doar valorile inițiale și finale. În acest caz, starea inițială corespunde cu H2O(1) iar sfârșitul lui H2O(v).
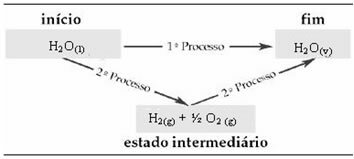
Această lege a devenit foarte importantă în termochimie, deoarece anumite reacții chimice nu pot avea ΔH determinate experimental. Totuși, conform legii lui Hess, entalpia acestui tip de reacție poate fi calculată din entalpiile altor reacții (reacții intermediare).
De Jennifer Fogaça
Absolvent în chimie
Echipa școlii din Brazilia


