Cinetica chimică studiază viteza reacțiilor chimice și factorii care influențează rata acestor reacții.
Utilizați întrebările de mai jos pentru a vă testa cunoștințele și pentru a verifica comentariile la rezoluții.
intrebarea 1
În ceea ce privește factorii care influențează viteza unei reacții chimice, este INCORECT să se afirme că:
a) Cu cât concentrația reactanților este mai mare, cu atât reacția este mai rapidă.
b) Cu cât suprafața de contact este mai mare, cu atât este mai mare viteza de reacție.
c) Cu cât este mai mare presiunea, cu atât reacția este mai rapidă.
d) Cu cât temperatura este mai mare, cu atât reacția este mai rapidă.
e) Prezența unui catalizator menține viteza de reacție constantă.
Alternativă incorectă: e) Prezența unui catalizator menține viteza de reacție constantă.
Catalizatorii măresc viteza de reacție, deoarece facilitează formarea complexului activat între reactanți.
Cu aceasta, catalizatorii creează un mecanism mai scurt pentru ca reacția să se dezvolte, determinând creșterea vitezei.
intrebarea 2
Conform _____________ trebuie să se producă coliziuni efective între reactivi pentru formarea produselor. În plus, există suficient ___________ pentru a rupe legăturile chimice ale reactanților și a forma un ___________, care este o stare intermediară înainte de formarea produselor.
Cuvintele care completează corect spațiile goale sunt, respectiv:
a) entalpia, energia cinetică și variația catalizatorului.
b) teoria coliziunii, energia activării și complexul activat.
c) viteza de reacție, entalpia și inhibitorul.
d) presiune parțială, entropie și substrat.
Alternativă corectă: b) teoria coliziunii, energia de activare și complexul activat.
Conform teoriei coliziunilor, coliziunile dintre reactanți sunt necesare pentru a avea loc o reacție chimică. Pentru aceasta, substanțele trebuie să fie într-o poziție favorabilă pentru ca șocurile să fie eficiente.
Energia de activare acționează ca o barieră energetică care trebuie depășită pentru a rupe legăturile compușilor care reacționează. Cu cât energia de activare este mai mică, cu atât reacția este mai rapidă.
Complexul activat este o specie intermediară instabilă formată înainte de produse.
întrebarea 3
Următoarele patru afirmații sunt făcute despre catalizatori:
I. Un catalizator funcționează prin creșterea vitezei unei reacții, dar fără schimbarea performanței sale.
II. Într-o reacție chimică, catalizatorul nu este consumat în calea reacției.
III. Catalizatorii creează o cale alternativă pentru transformarea reactanților în produse. Pentru aceasta, este nevoie de o energie mai mare de activare.
IV. Catalizatorul poate accelera reacția numai în direcția înainte.
Opțiunile care prezintă informații corecte despre catalizatori sunt:
a) I și II
b) II și III
c) I și IV
d) Toate
Alternativă corectă: a) I și II.
Catalizatorii sunt folosiți pentru a accelera reacțiile chimice. Reacția utilizând catalizatorul nu își schimbă randamentul, adică se produce cantitatea așteptată de produs, dar în mai puțin timp.
Catalizatorii nu sunt consumați în timpul reacției chimice, ci ajută la formarea complexului activat. Prin urmare, un catalizator poate fi recuperat la sfârșitul reacției chimice.
Catalizatorii sunt capabili să reducă timpul de reacție prin crearea unui mecanism alternativ pentru formarea produselor cu energie de activare mai mică. Prin urmare, reacția are loc mai repede.
Catalizatorii acționează atât în direcția înainte, cât și în direcția inversă a reacției.
întrebarea 4
Cât de repede are loc o reacție chimică depinde de:
I. Numărul de coliziuni efective între reactivi.
II. Suficient de energie pentru a rearanja atomii.
III. Orientarea favorabilă a moleculelor.
IV. Formarea unui complex activat.
a) I și II
b) II și IV
c) I, II și III
d) I, II, III și IV
Alternativă corectă: d) I, II, III și IV.
Coliziuni eficiente apar atunci când reactanții sunt în poziții favorabile șocurilor, ceea ce va promova rearanjarea atomilor.
Energia de activare trebuie să fie suficientă pentru ca coliziunea dintre reactanți să aibă ca rezultat ruperea legăturilor și formarea complexului activat.
Nu toate coliziunile dintre particulele care reacționează determină reacția. Orientarea cu care se produce coliziunea este importantă pentru formarea produselor.
Complexul activat este o stare intermediară și instabilă înainte de formarea produselor. Este creat atunci când energia de activare a reacției este depășită.
întrebarea 5
Dioxidul de carbon este un gaz format prin reacția dintre monoxidul de carbon și gazele de oxigen, conform ecuației chimice de mai jos.
CO(g) + ½2 (g) → CO2 (g)
Știind că în 5 minute de reacție s-au consumat 2,5 mol de CO, care este viteza de dezvoltare a reacției în funcție de consumul de O2?
a) 0,2 mol. min-1
b) 1,5 mol. min-1
c) 2,0 mol. min-1
d) 0,25 mol. min-1
Alternativă corectă: d) 0,25 mol. min-1
Pentru a răspunde la această întrebare trebuie să ne uităm la ecuația chimică.
CO(g) + ½2 (g) → CO2 (g)
Rețineți că 1 mol de monoxid de carbon reacționează cu ½ mol de oxigen pentru a forma 1 mol de dioxid de carbon.
Cantitatea dată în declarație se referă la monoxid de carbon, dar răspunsul trebuie să fie în termeni de oxigen. Pentru aceasta trebuie să îndeplinim o regulă de trei și să găsim cantitatea de oxigen.
1 mol CO - ½ mol O2
2,5 mol CO - x de O2
x = 1,25 mol
Acum aplicăm valorile din formula pentru rata de dezvoltare a reacției.
Prin urmare, viteza de dezvoltare a reacției față de oxigen este de 0,25 mol.min-1.
întrebarea 6
Rețineți reprezentarea grafică a dezvoltării unei reacții chimice ipotetice, care leagă energia și calea de reacție.
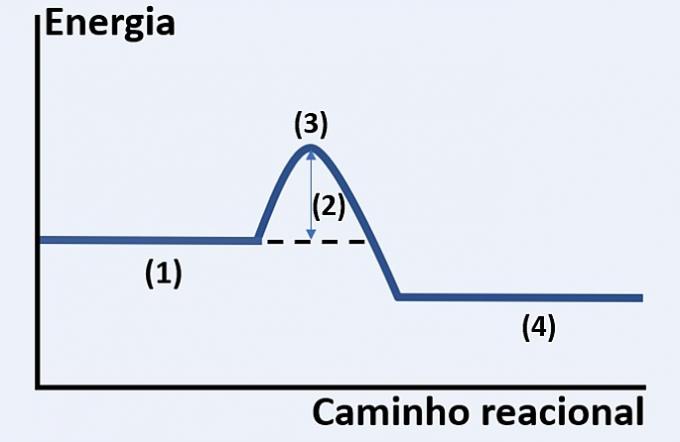
Verificați alternativa care înlocuiește corect (1), (2), (3) și respectiv (4).
a) substraturi, căldură degajată, stare de energie maximă și sfârșitul reacției.
b) reactivi, energie de activare, complex activat și produse.
c) reactanți, energie cinetică, catalizator și substraturi.
d) reactanți, căldură absorbită, energie termică și produse.
Alternativă corectă: b) reactivi, energie de activare, complex activat și produse.
Graficul prezentat este al unei reacții endoterme, adică există o absorbție de energie pentru ca reacția să aibă loc.
Tu reactivi (1) sunt la începutul graficului și energie activatoare (2) corespunde diferenței dintre energia stocată în reactanți și în complex activat (3). În cele din urmă, după trecerea stării intermediare, formarea produse (4).
Prin urmare, reactanții trebuie să depășească energia de activare pentru a-și rearanja atomii într-o structură intermediară numită complex activat pentru a se forma produsele.
întrebarea 7
Substanța A este capabilă să se descompună și să devină substanța B. Observați dezvoltarea acestei reacții în imaginea de mai jos.

În ceea ce privește viteza de reacție, putem spune că:
a) Substanța A se descompune între 0 și 15 s la o rată de 0,35 mol.s-1.
b) Substanța A se descompune între 15 și 30 s la o rată de 0,02 mol.s-1.
c) Substanța A se descompune între 0 și 15 s la o rată de 0,04 mol.s-1.
d) Substanța A se descompune între 15 și 30 s la o rată de 0,03 mol.s-1.
Alternativă corectă: d) Substanța A se descompune între 15 și 30 s la o rată de 0,03 mol.s-1.
Rata de descompunere a substanței A poate fi calculată prin formula:
Să calculăm viteza de reacție în termeni de substanță A între intervalele date.
Interval între 0 și 15:
Interval între 15 și 30:
Prin urmare, alternativa d este corectă, deoarece substanța A se descompune între 15 și 30 s la o rată de 0,03 mol.s.-1.
întrebarea 8
Luați în considerare următoarea reacție ipotetică.
aA + bB → cC + dD
Observați variația concentrației de A și C de mai jos.
| Timp (uri) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Consumul de A (mol / L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Formarea C (mol / L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Pe baza informațiilor furnizate în întrebare, care este, respectiv, rata consumului de A și rata de formare a C în intervalul cuprins între 5 și 25 de minute?
a) 0,3 mol. L-1.s-1 și 0,1 mol. L-1.s-1
b) - 0,1 mol. L-1.s-1 și 0,3 mol. L-1.s-1
c) - 0,25 mol. L-1.s-1 și 0,1 mol. L-1.s-1
d) 0,1 mol. L-1.s-1 și 0,3 mol. L-1.s-1
Alternativă corectă: c) - 0,25 mol. L-1.s-1 și 0,1 mol. L-1.s-1.
O rată de consum:
Rata de antrenament C:
Prin urmare, în reacție, A este consumat la o rată de 0,25 mol.s-1, deci valoarea sa este negativă, în timp ce B este format la o rată de 0,1 mol. L-1.s-1.
Citește și tu:
- Cinetica chimică
- termochimie
- Echilibrul chimic
- Reacții chimice



