O Diagrama fazelor este un grafic care vă permite să definiți în ce stare fizică se află o substanță la un moment dat, cunoscând temperatura și presiunea acesteia.
Măsurătorile de laborator sunt utilizate pentru a construi diagrama de fază a unei substanțe date.
Diagrama este împărțită în trei regiuni, care reprezintă starea solidă, lichidă și vapori.
Punctele de pe liniile care delimitează aceste regiuni indică valorile temperaturii și presiunii pe care substanța le poate avea în două stări.
O diagramă de fază are următoarele elemente:
- curba de Fuziune: separă zonele corespunzătoare stărilor solide și lichide.
- curba de vaporizare: separă zonele corespunzătoare fazelor lichide și vapori.
- curba de sublimare: separă zonele corespunzătoare fazelor solide și vapori.
- punct triplu: punctul de intersecție al celor trei curbe (fuziune, vaporizare și sublimare). Acest punct indică valorile de temperatură și presiune pe care substanța le poate avea simultan în cele trei stări.
- Punct critic: indică cea mai ridicată temperatură pe care substanța este vapori. Din acel moment, nu mai este posibil să se facă diferența între stările lichide și vapori. La temperaturi peste punctul critic, substanța devine gaz.
În figura de mai jos, prezentăm o reprezentare a unei diagrame de fază:

Citiți mai multe la: Modificările stării fizice.
curba de topire
Substanțele, în general, cresc în volum când sunt supuse fuziunii și, dimpotrivă, scad în volum când se solidifică. În consecință, o creștere a presiunii duce la o creștere a punctului de topire (temperatura de topire).
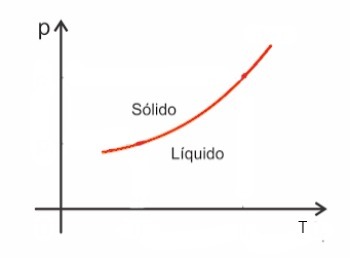
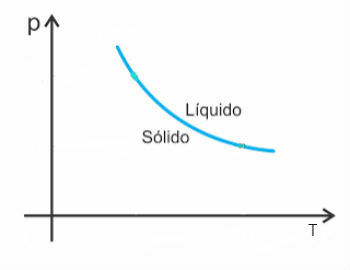
Cu toate acestea, există unele excepții printre acestea apa, care în topire scade în volum. În acest caz, o creștere a presiunii determină o scădere a punctului de topire.
Astfel, curba de topire a acestor substanțe va arăta astfel:
Exemplu
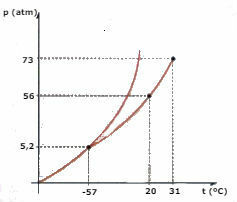
Luați în considerare diagrama de fază CO2 (dioxid de carbon) reprezentat mai jos și răspundeți la întrebări:
a) Ce fază este CO2 , când temperatura dvs. este de -60 ° C și presiunea este de 50 atm?
b) O anumită cantitate de CO2 lichidul este supus unei presiuni de 56 atm și este închis într-un recipient. Dacă lichidul este încălzit, menținând presiunea constantă, care este valoarea temperaturii la care se va produce vaporizarea?
c) Care este valoarea temperaturii și a presiunii punctului triplu al CO2?
d) O bucată de gheață uscată (CO2) este supus unei presiuni de 2 atm. Este încălzit, menținând presiunea constantă. La un moment dat începe o schimbare de fază. Care este numele acestei schimbări?
Rezoluţie:
a) Observând diagrama, concluzionăm că CO2 va fi în faza solidă.
b) Vaporizarea va avea loc atunci când temperatura atinge 20 ° C.
c) Punctul triplu corespunde intersecției celor trei curbe, în cazul CO2, când are o temperatură de -57 ° C și o presiune de 5,2 atm, cele trei stări fizice pot coexista.
d) Va apărea sublimarea
Pentru a afla mai multe, citiți și:
- Solidificare
- Punct de topire și fierbere
- Evaporare
- Condensare
Exerciții rezolvate
1) Enem - 2000
Chiar și astăzi, este foarte obișnuit ca oamenii să folosească recipiente de lut (borcane sau vase din ceramică fără glazură) pentru a conserva apa la o temperatură mai mică decât cea a mediului. Asta pentru ca:
a) argila izolează apa din mediul înconjurător, păstrând-o întotdeauna la o temperatură mai scăzută decât a sa, ca și cum ar fi spumă de poliester.
b) argila are puterea de a „îngheța” apa datorită compoziției sale chimice. În reacție, apa pierde căldură.
c) argila este poroasă, permițând trecerea apei prin ea. O parte din această apă se evaporă, luând căldură din moringa și din restul apei, care sunt apoi răcite.
d) argila este poroasă, permițând apei să se așeze pe exteriorul ulciorului. Apa din exterior este întotdeauna la o temperatură mai ridicată decât în interior.
e) Moringa este un fel de frigider natural, care eliberează substanțe higroscopice care reduc în mod natural temperatura apei.
Alternativa c: argila este poroasă, permițând trecerea apei. O parte din această apă se evaporă, luând căldură din moringa și din restul apei, care sunt apoi răcite.
2) Ita - 2013
Luați în considerare diagrama de fază ipotetică reprezentată schematic în următoarea figură:

Ce reprezintă punctele A, B, C, D și E?
punctul A: punctul de sublimare
punctul B: punct triplu
Punctul C: punctul de topire / solidificare
punctul D: punctul de vaporizare / condensare
punctul E: punct critic
3) UECE - 2009
Privind diagrama de fază PT prezentată mai jos. Se poate concluziona, corect, că o substanță care a trecut prin procesul de sublimare urmează traiectoria:

a) X sau Y
b) Y sau U
c) U sau V
d) T sau X
Alternativa b: Y sau U


