se definește ca fiind hibridizare unirea orbitalilor atomici incompleti. Un orbital este clasificat ca incomplet atunci când are doar unul electron în interiorul ei în loc de două. Vedeți o reprezentare a unui orbital incomplet și a unui orbital complet:

În imaginea A, avem un orbital complet; în imaginea B, un orbital incomplet.
Hibridizarea este un fenomen natural care apare cu unele elemente chimice, precum fosfor, sulf, carbon etc. Hibridizarea carbonului permite atomilor acestui element să fie capabili să facă patru legături chimice, adică carbonul face doar patru legături după ce a suferit fenomenul de hibridizare.
Dar de ce carbonul se hibridizează și creează patru legături? Pentru a înțelege acest fenomen, trebuie să cunoaștem distribuția electronică a acestui element:
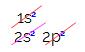
În distribuția electronică a carbonului, vedem că subnivelul 1s este complet (cu doi electroni), 2s este complet (cu doi electroni) și subnivelul 2p este incomplet (subnivelul p suportă șase electroni, dar există doar Două). Distribuind electronii 2p într-un mod reprezentativ, trebuie să:
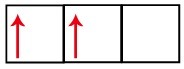
Subnivelul p are trei orbitali - în cazul carbonului, doi dintre ei sunt incompleti și unul este gol. Din acest motiv, acest element ar trebui să efectueze doar două legături, deoarece numărul orbitelor incomplete determină întotdeauna numărul de legături.
Cu toate acestea, atunci când primesc energie din mediul extern, electronii prezenți în carbon sunt excitați. Astfel, unul dintre electronii prezenți în subnivelul 2 se deplasează pe orbitalul subnivelului p care era gol:
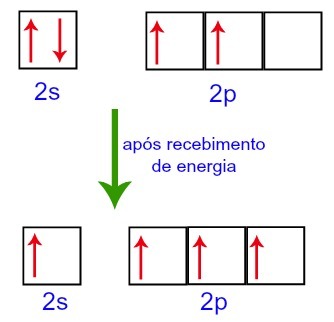
Orbitalii de carbon înainte și după primirea energiei din mediul extern
Astfel, carbonul rămâne cu patru orbitali incompleti la al doilea nivel. Apoi, orbitalul subnivelului 2s se alătură celor trei orbitali p, ceea ce configurează fenomenul de hibridizare.
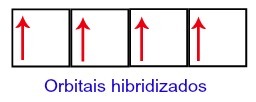
Orbitalii carbonului după hibridizare
De mine. Diogo Lopes Dias
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm

