Structura proteinelor se referă la conformația sa naturală necesară pentru a-și îndeplini funcțiile biologice.
Proteinele sunt macromolecule formate prin unirea aminoacizilor.
Aminoacizii sunt legați între ei prin legături peptidice. Moleculele rezultate din îmbinarea aminoacizilor se numesc peptide.
Proteinele au patru niveluri structurale: structura primară, secundară, terțiară și cuaternară.
Structura primară a proteinelor
Structura primară corespunde secvență liniară de aminoacizi unite prin legături peptidice.
În unele proteine, înlocuirea unui aminoacid cu alta poate provoca boli și chiar moarte.
Structuri spațiale ale proteinelor
Structurile spațiale ale proteinelor rezultă din plierea și plierea firului de proteine pe sine.
Proprietățile funcționale ale proteinelor depind de structura lor spațială.
Structura secundară
Structura secundară corespunde primului nivel de înfășurare elicoidală.
Se caracterizează prin modele regulate și repetitive care apar local, cauzate de atracția dintre anumiți atomi de aminoacizi din apropiere.
Cele mai comune două aranjamente locale care corespund structurii secundare sunt alfa-helix și beta-frunze sau beta-plisate.
- conformația helix alfa: caracterizat printr-un aranjament tridimensional în care lanțul polipeptidic își asumă o conformație elicoidală în jurul unei axe imaginare.
- conformația foii beta: apare atunci când lanțul polipeptidic se extinde în zig-zag și poate fi aranjat unul lângă altul.
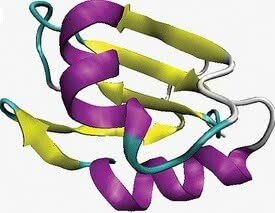
Structura secundară. În violet, conformația alfa-helix și în galben, frunza beta
Structura terțiară
Structura terțiară corespunde plierii lanțului polipeptidic pe sine.
În structura terțiară, proteina capătă o formă tridimensională specifică datorită plierii globale a întregului lanț polipeptidic.
Structura cuaternară
În timp ce multe proteine sunt formate dintr-un singur lanț polipeptidic. Altele sunt alcătuite din mai multe lanțuri polipeptidice.
Structura cuaternară corespunde a două sau mai multe lanțuri polipeptidice, identice sau nu, care grupează și se potrivesc împreună pentru a forma structura totală a proteinei.
De exemplu, molecula de insulină este alcătuită din două lanțuri interconectate. Între timp, hemoglobina este alcătuită din patru lanțuri polipeptidice.
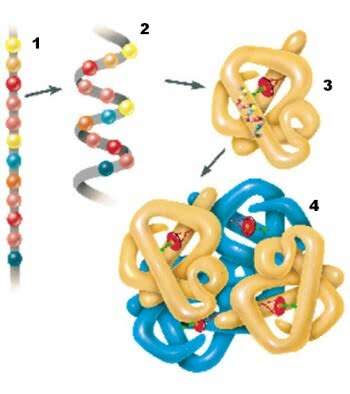
1. Structura primară; 2. Structura secundară; 3. Structura terțiară; 4. Structura cuaternară.
Află mai multe despre Proteine.
Denaturarea proteinelor
Pentru a-și îndeplini funcțiile biologice, proteinele trebuie să prezinte conformația lor naturală.
Căldura, aciditatea, concentrația de sare, printre alte condiții de mediu pot modifica structura spațială a proteinelor. Ca rezultat, lanțurile lor polipeptidice se desfac și își pierd conformația naturală.
Când se întâmplă acest lucru, îl numim denaturarea proteinelor.
Rezultatul denaturării este pierderea funcției biologice caracteristice proteinei respective.
Cu toate acestea, secvența de aminoacizi nu este modificată. Denaturarea corespunde doar pierderii conformației spațiale a proteinelor.
Pentru a afla mai multe, citiți și despre peptide și legături peptidice.