Când spunem cuvântul „echilibru” îmi vine în minte un obiect care rămâne la nesfârșit. Cu toate acestea, acesta este doar un fel de echilibru, numit „Echilibru static”.
Există, de asemenea, "echilibru dinamic". În ea, așa cum spune și numele, nu există niciun moment în care obiectul sau fenomenul în cauză să fie încă. De exemplu, pentru a înțelege, consultați ilustrația de mai jos și rețineți că cantitatea de apă care cade în recipient este egală cu cantitatea care curge din acesta, menținând nivelul apei constant. În acest caz, spunem că există un echilibru dinamic, un echilibru în mișcare.

Acest tip de echilibru apare în reacții reversibile, adică în acele reacții care apar în ambele direcții. În același timp în care moleculele reactanților sunt transformate în produse, moleculele produselor reacționează între ele pentru a forma reactanții. Reversibilitatea unei reacții este reprezentată de săgeți în ambele direcții:
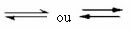
Când rata de dezvoltare a reacției directe (de formare a produselor) este egală cu rata de dezvoltare a reacția inversă (formarea reactanților), la temperatură constantă, înseamnă că reacția și-a atins echilibrul chimic. Și în cazul reacțiilor cu prezența doar a moleculelor în reactanți și produse, avem un echilibrul molecular.
Următorul este un exemplu de reacție care are loc între hidrogen gazos (H2) și gaz de iod (I2), pentru formarea gazului de iodură de hidrogen (HI):
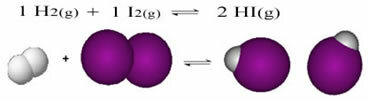
La începutul reacției, viteza de dezvoltare a reacției directe a fost mai mare, după ce toată concentrația reactanților a fost maximă și cea a produselor a fost zero. Deci, rata de dezvoltare a reacției inverse a fost de asemenea zero.
Cu toate acestea, în timp, hidrogenul și gazele de iod reacționează, generând produsul. În acest fel, concentrația reactivilor începe să scadă și rata lor de dezvoltare scade, de asemenea.
Pe măsură ce concentrația produselor crește și concentrația reactanților scade, rata de dezvoltare a reacției inverse începe să crească. Dacă temperatura este menținută constantă, va veni un moment în care cele două rate de dezvoltare vor rămâne aceleași, arătând astfel că reacția a atins echilibrul molecular chimic.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm

