Elemente numite după metale alcalino-pământoase sunt cele care aparțin familiei 2 sau IIA, din tabelul periodic. Un astfel de grup cuprinde următoarele elemente chimice: Fii (beriliu), Mg (magneziu), Ca (calciu), Sr (stronțiu), Ba (bariu) și radiu (Ra).

Au doi electroni în coaja de valență, iar distribuția lor generică este reprezentată de ns2, unde Nu reprezintă numărul ultimului nivel. Datorită acestei caracteristici, ei tind să piardă acești doi electroni, dând naștere la 2+ cationi de încărcare.
Termenul „pământ” se referă la „existent pe pământ”, deoarece aici se găsesc aceste elemente, în principal în minerale. De exemplu, calciu, sub formă de compus fosfat de calciu (Ca3(PRAF4)2), se găsește în scoarța terestră și servește ca materie primă pentru producerea fosforului. Este prezent și în oasele animalelor, atât de mult încât, atunci când acestea sunt calcinate, se obține așa-numita „făină de oase”, care conține fosfat de calciu.
Dintre metalele alcalino-pământoase, cele care se remarcă cel mai mult sunt Calciu este Magneziu.
- Calciu
Ionul calciu (Ca2+) este prezent în aproximativ 90% din oase și dinți; iar la animale este prezent și în cochiliile lor. Funcția sa este de a întări structura osoasă și de a servi ca relaxant muscular. Lipsa de calciu din organism poate provoca crampe musculare, tetanos și osteoporoză. De aceea, este important să îl consumați prin alimente bogate în calciu, cum ar fi laptele și derivații săi (unt, brânză etc.), carne și legume.
Pe de altă parte, prea mult calciu poate provoca relaxare musculară, pietre la rinichi și dureri osoase.
În plus față de alimentele menționate anterior, calciul este încă prezent în multe părți ale naturii, în special în minerale precum calcitul (CaCO3) sau carbonat de calciu, care este un element constitutiv al calcarului și marmurii, iar marmura este utilizată la fabricarea chiuvetelor, statuilor, podelelor și scărilor. Carbonatul de calciu este, de asemenea, constructorul stalactitelor și stalagmitelor din peșteri. Calciul este prezent și în gipsul natural (CaSO4. 2 ore2O), numit gips. Această sare poate fi deshidratată, dând naștere la CaSO4 anhidru, care este creta școlară.
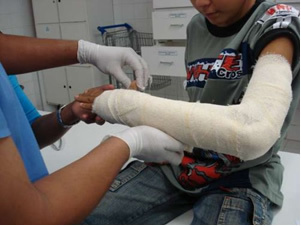
În industrie, se produce var virgin (CaO), var stins, numit și var hidratat sau var stins, care este de fapt hidroxid de calciu (Ca (OH)2), utilizat în vopselele de albire și la prepararea mortarului. Încălzirea ușoară a gipsului permite obținerea sulfatului de calciu hemihidratat, care este gipsul, utilizat în construcții în producția de matrițe în stomatologie și medicină pentru protejarea fracturilor osoase, cum ar fi cea din braț prezentată mai jos.
- Magneziu
ionul de magneziu are, de asemenea, o mare importanță biologică, deoarece este prezentă în 70% din oasele noastre, favorizând acțiunea enzimelor, a mușchilor și a coordonării motorii. Lipsa sa în organism poate provoca dezorientare, hipertensiune, tremurături și un puls slab. Prin urmare, ar trebui să consumăm următoarele alimente care conțin acest element: nuci, cereale și legume verzi. De asemenea, excesul de magneziu din organism poate provoca somnolență.
Magneziul există și în apa de mare și în minerale. Este utilizat în aliaje metalice, cum ar fi metalele de sacrificiu (care se oxidează în locul oțelului, prevenind coroziunea acestuia), în roțile de „magneziu” și în focurile de artificii (oferind culorile argintiu și alb). Un compus foarte important de magneziu este hidroxidul de magneziu (Mg (OH)2), care, atunci când este dispersat în apă, la o concentrație de aproximativ 7%, dă naștere unei suspensii cunoscute popular ca lapte de magnezie, care servește ca antiacid, combatând aciditatea stomacului (arsuri la stomac) și ca laxativ.

De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm
