Așa cum se explică în text Stări fizice ale apei și schimbările sale, schimbarea de la solid la lichid se numește Fuziune. Prin urmare,punctul de topire este temperatura la care o substanță pură care se afla în stare solidă se transformă în stare lichidă.
Dacă luați un cub de gheață care se afla în frigider la temperatura de -5 ° C și îl lăsați afară într-o zi fierbinte, ce se va întâmpla? Este simplu, cubul de gheață va începe să se topească. Dar asta nu se va întâmpla decât după ce l-ai scos din frigider. Acest lucru se datorează faptului că temperatura gheții începe să crească, mergând de la -5 ° C la -4 ° C, apoi la -3 ° C și așa mai departe până când ajunge la 0 ° C. Aceasta este temperatura la care începe să se topească gheața. Deci putem spune asta punctul de topire sau temperatura de topire a gheții este egal cu 0 ° C (la nivelul mării).
* Amintind că ºC înseamnă grade Celsius, care este o măsură a temperaturii.

topirea gheții sau topirea
Cel mai interesant lucru este că temperatura rămâne la aceeași valoare pe tot parcursul schimbării stării fizice. Aceasta înseamnă că, în cazul gheții, după ce atinge punctul de topire, temperatura sa este fixată la 0 ° C până când toată gheața se transformă în stare lichidă.
Acest lucru poate fi vizualizat într-un grafic ca cel prezentat mai jos. Rețineți că, până la atingerea temperaturii de topire, temperatura a continuat să crească, dar când s-a atins această temperatură, a rămas fixă în timp, formând un platou:

Graficul punctului de topire a gheții
Punctul de fierbere este temperatura la care o substanță pură se schimbă dintr-un lichid în stare de vapori. Așa se întâmplă când punem apa lichidă care iese din robinet în foc. Temperatura sa crește până ajunge la o temperatură de 100 ° C, care este punctul de fierbere al apei (la nivelul mării).
În figura următoare, puteți vedea că atunci când lichidul este încălzit, apare o creștere a agitației. din particulele sale, care le permite să scape din recipient și să se amestece cu aerul. Bulele formate la temperatura de fierbere sunt bulele de vapori de apă.
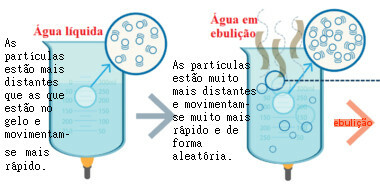
Mișcarea particulelor de apă clocotită
La punctul de fierbere, același lucru se întâmplă ca la punctul de topire, adică temperatura rămâne la aceeași valoare în timpul schimbării de stare.
Următorul grafic arată punctul de topire (MP) și punctul de fierbere (PE) al apei:

Graficul modificării stării fizice a apei la nivelul mării
Punctele de topire și de fierbere sunt proprietăți importante ale substanțelor, deoarece fiecare are o temperatură de topire și o temperatură de fierbere specifice. Nu există două sau mai multe substanțe cu aceleași puncte de topire și fierbere. Singura substanță cunoscută cu un punct de topire de 0 ° C și un punct de fierbere de 100 ° C la nivelul mării este apa.
Prin urmare, aceste cantități sunt utilizate pentru identificarea substanțelor. A se vedea câteva valori ale punctului de topire și de fierbere pentru alte substanțe:

Punctele de topire și fierbere ale unor materiale prezente în viața de zi cu zi
Cu toate acestea, este de remarcat faptul că temperaturile de topire și fierbere vor avea valori fixe numai dacă substanța este pură. În cazul amestecurilor, aceste valori variază, adică fierb la o temperatură și ajung să-și schimbe starea fizică la alta. Astfel, graficele modificărilor stării fizice a amestecurilor nu au acele două praguri fixe pentru punctul de topire și pentru punctul de fierbere.
De Jennifer Fogaça
Absolvent în chimie