Tu oxizi acestea sunt alcătuite din două elemente diferite, dintre care unul este oxigenul, care trebuie să fie cel mai electronegativ dintre cele două.
Nomenclatura oxizilor anorganici urmează reguli care depind de oxidul molecular, covalent sau ionic. Să analizăm fiecare caz:
* Nomenclatura oxizilor moleculari sau a rețelei covalente:
Oxizii de rețea moleculară sau covalentă sunt cei care au oxigen atașat la o ametal, cum ar fi carbon (C), azot (N), sulf (S), fluor (F), printre altele. Nomenclatura acestor oxizi urmează următoarea regulă:

Regula nomenclaturii pentru oxizii formați cu nemetale
Prefixul mono din fața elementului legat de oxigen este opțional.
De exemplu, avem următorul oxid molecular: CO.
- Prefix care indică cantitatea de oxigen: 1 oxigen: mono;
- oxid de;
- Prefix care indică numărul de atomi ai celuilalt element: 1 carbon: mono;
- Denumirea elementului legat de oxigen: carbon.
Deci, numele tău este așa: CO = monoxid de monocarbon sau monoxid de carbon.
Vedeți mai multe exemple:
dioxid de carbon - CO
2Trioxid de sulf - SO3
Heptoxid de diclor - Cl2O7
Monoxid de dinitrogen - N2O
Trioxid de dinitrogen - N2O3
Monoxid de azot -NO
Dioxid de azot - NU2
Pentoxid de dinitrogen - N2O5
Dioxid de siliciu - SiO2
Pentoxid de difosfor - P2O5
Trioxid de sulf - SO3
* Nomenclatura oxizilor ionici:
Oxizii ionici sunt cei care au oxigen legat de o metal, cum ar fi fier (Fe), plumb (Pb), sodiu (Na), calciu (Ca), argint (Ag), printre altele. În general, încărcarea electrică a oxigenului este de -2.
Nomenclatura menționată pentru oxizii de rețea moleculară sau covalentă se aplică în prezent și oxizilor metalici și este considerată oficială. Vezi câteva exemple:
Monoxid de fier - FeO
Monoxid de plumb - PbO
Dioxid de plumb - PbO2
Trioxid diferit - Fe2O3
Cu toate acestea, există o nomenclatură specifică pentru oxizii metalici care este încă utilizată pe scară largă. Se bazează pe valența elementului legat de oxigen.
Dacă elementul are o singură valență, adică, dacă există o singură modalitate de a lega oxigenul și de a forma un singur tip de oxid, regula de denumire va fi dată de:

Regula de denumire a oxidului ionic monovalent
Exemple:
- Oxid de sodiu - Na2O
- Oxid de calciu - CaO
- Oxid de potasiu - K2O
- Oxid de aluminiu - Al2O3
- Oxid de argint - Ag2O
Există însă și oxizi ionici formați din elemente cu mai mult de o valență. În aceste cazuri, regula de numire este următoarea:
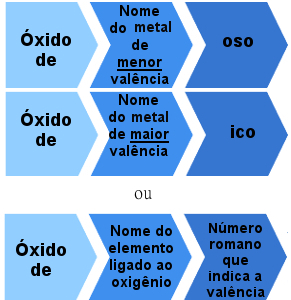
Regula nomenclaturii pentru oxizii ionici cu mai mult de o valență
Exemple:
Oxid feros - FeO
Oxid feric - Fe2O3
Oxid de cupru - Cu2O
oxid cupric - CuO
Sau:
Oxid de fier II - FeO (Nox de fier = +2)
Oxid de fier III - Fe2O3 (Nox de fier = +3).
Oxid de cupru I - Cu2O (Nox de fier = +1)
Oxid de cupru II - CuO (fier nox = +2).
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/nomenclatura-dos-oxidos.htm
