
Uneori se poate întâmpla formula minimă să fie aceeași cu formula moleculară a compusului; cu toate acestea, acest lucru nu este întotdeauna adevărat.
De exemplu, formula empirică sau minimă pentru apă este H2O, indicând faptul că există un raport 2: 1 între elementele care alcătuiesc moleculele de apă. Și, întâmplător, aceasta este și formula moleculară pentru apă. Cu toate acestea, pentru a vedea că acest lucru nu se întâmplă întotdeauna, uitați-vă la cele două exemple de mai jos:
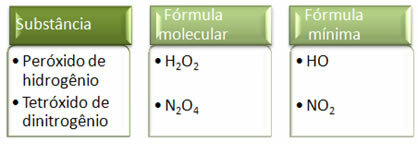
Deoarece formula minimă este doar raportul atomilor fiecărui element și nu cantitatea reală a acestora în formula moleculară, se poate produce de compuși diferiți având aceeași formulă empirică și chiar formula minimă a unui compus poate fi aceeași cu formula moleculară a alte. Rețineți, în exemplul de mai jos, cum se poate întâmpla acest lucru:
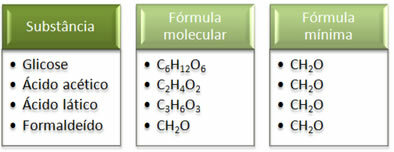
Vedeți că formula minimă CH2Același lucru este același pentru toate substanțele, adică această formulă minimă exprimă faptul că, în toate cazurile, atomii de carbon, hidrogen și oxigen sunt prezenți în formulele moleculare într-un raport de 1:2:1. Mai mult, singura care are aceeași formulă moleculară ca formula empirică este formaldehida.
- Calculul formulei minime sau empirice:
Pentru a determina formula empirică a unui compus, este mai întâi necesar să știm care este procentul sau formula sa apropiată. Acest lucru se poate face prin măsurarea masei fiecărui element în 100g dintr-o probă. Textul "Procent sau Formula centesimală”Clarifică mai bine această chestiune.
Nu te opri acum... Există mai multe după publicitate;)
De exemplu, să presupunem că compoziția apropiată a unui compus dat este dată de: 40,00% C, 6,67% H și 53,33% O. Transmitem aceste valori la grame, având în vedere o masă de 100 g de probă compusă. Astfel, avem: 40 g de C, 6,67 g de H și 53,33 g de O.
Acum este necesar să treceți aceste valori la cantitatea de materie (mol). Facem acest lucru împărțind fiecare dintre valorile găsite de masele lor molare respective:
C: 40/12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Deoarece valorile nu sunt întregi, folosim următorul dispozitiv: împărțim toate valorile la cel mai mic dintre ele, astfel încât proporția dintre ele să nu fie modificată.
În acest caz, cea mai mică valoare este 3,33, deci rezultatul va fi:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
Astfel, formula minimă a acestei substanțe necunoscute este egală cu: Ç1H2O1 sau CH2O.
Pe scurt, pașii necesari pentru a găsi formula empirică sau minimă a unei substanțe sunt:

De Jennifer Fogaça
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Formula minimă sau empirică”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Accesat la 28 iunie 2021.



