Luați în considerare reacția reversibilă generică de mai jos, unde literele minuscule corespund coeficienților de reacție echilibrați, iar literele mari sunt reactanții și produsele sunt toate gazoase:

Având în vedere fiecare dintre direcțiile de reacție separat, ratele lor de dezvoltare (Td) sunt date de:
* Reacție directă: aA + bB → cC + dD
Toatedirect = Kdirect. [THE]. [B]B
* Reacție inversă: cC + dD → aA + bB
Toateinvers = Kverso. [Ç]ç. [D]d
Constanta de echilibru chimic în termeni de concentrație în cantitate de materie (Kç) și în termeni de presiune parțială (KP) se va da prin divizarea lui Kdirect de Kverso.
Deci avem:
Kdirect. [THE]. [B]B = 1 → Kdirect__ = __[Ç]ç. [D]d___
Kverso. [Ç]ç. [D]d Kverso [THE]. [B]B
Ființa, Kç =_Kdirect_
Kverso
Deci avem:
Kç =__[Ç]ç. [D]d___ sau KP =__(Praça)ç. (pD)d___ |
Unde p este presiunea parțială a fiecărei substanțe la echilibru.
În acest fel, fiecare concentrație este crescută la un exponent corespunzător coeficientului substanței respective în reacție și Kç nu are unitate *.
În plus, un aspect foarte important de subliniat este acela din această expresienici componentele solide, nici lichidele pure nu trebuie reprezentate., întrucât numai aspectele care pot suferi variații participă la această expresie. Concentrația în cantitate de materie a unei substanțe în stare solidă este constantă și, prin urmare, este deja inclusă în valoarea lui K în sine.ç. Același lucru este valabil și pentru lichidele pure, cum ar fi apa. Pe scurt, la termen participă doar substanțe în stare gazoasă și în soluție apoasă
Nu te opri acum... Există mai multe după publicitate;)
Rețineți exemplele de mai jos:
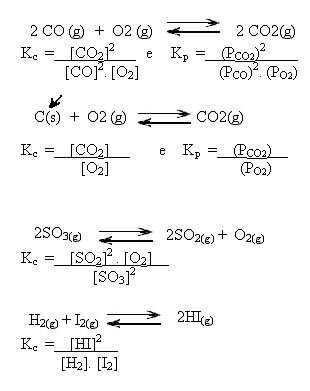
K valoriç ne poate arăta dacă concentrația de reactanți și produse este aceeași sau dacă una este mai mare decât cealaltă:
- dacă Kç sau KP este egal cu unul (Kç = 1), aceasta înseamnă că concentrația de reactanți și produse este egală;
- Dacă valoarea lui Kç sau KP fii înalt, aceasta înseamnă că produsele sunt într-o concentrație mai mare, deoarece în expresia lui Kç produsele sunt în numerator;
- Dacă valoarea lui Kç sau KP este scăzut, aceasta înseamnă că reactivii sunt în concentrație mai mare, deoarece în expresia lui Kç reactivii sunt în numitor.
* Kç și KP sunt numere adimensionale, adică numere pure, fără nicio unitate legată de vreo magnitudine sau relație între magnitudini.
De Jennifer Fogaça
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau în o lucrare academică? Uite:
FOGAÇA, Jennifer Rocha Vargas. „Constantele de echilibru Kc și Kp”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Accesat la 28 iunie 2021.