Din cele mai vechi timpuri, omul a fost interesat să răspundă la întrebarea despre constituirea materiei.
Mai multe personalități din comunitatea științifică s-au pronunțat asupra acestui subiect, dar abia la sfârșitul secolului al XIX-lea au început să fie dezvăluite misterele despre compoziția atomică.
Filosoful antic Leucipp, de exemplu, credea că atomul era format din particule minuscule.
După această definiție, Democritus și Dalton au propus că particulele atomice erau masive și indivizibile.
Acest fapt a fost contestat ulterior de Thomson, un fizician englez care a descoperit existența electronului și a reușit, apoi, să confirme ideea propusă anterior de Leucipo.
După această descoperire, Thomson a prezentat un model în care atomul era format dintr-o sferă de sarcini pozitive și în interiorul nucleului erau electroni.
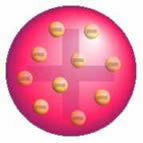
Modelul atomic al lui Thomson - Într-o sferă de masă încărcată pozitiv, distribuită uniform,
ar fi încrustați cu electroni încărcați negativ, ca într-o budincă.
Chiar și după teoria lui Thomson, modelul atomic avea încă o deficiență teoretico-experimentală, capabilă să-și demonstreze veridicitatea.
Subiectul a fost din nou discutat cu căldură atunci când echipa fizicianului Rutherford a observat că există o abatere foarte mare (și inexplicabil, conform teoriei budincii de stafide) când unele particule alfa radioactive au trecut printr-un strat subțire de lamă metalic.
După analizarea și studierea faptului, Rutherford a ajuns la concluzia că raza atomului este de 10.000 de ori mai mare decât raza nucleului.
Prin tot studiul atomului, Rutherford și echipa sa au ajuns, în 1911, la un model atomic, pe care l-au numit modelul planetar al atomului.
Nu te opri acum... Există mai multe după publicitate;)

În 1913, Niels Bohr a descifrat modelul atomic, aplicând cuantumul de acțiune descoperit de Planck studiilor sale. Cuantumul acțiunii a fost, de fapt, marele wildcard care va veni să completeze și să clarifice modelul atomic.
Bohr a ajustat eficient și simplu modelul prezentat de Rutherford ajungând la următoarea concluzie:
Electronul capătă energie, care este reprezentată printr-o orbită definită. Orbitele permise formează nivelurile de energie.

De Talita A. îngeri
Absolvent în fizică
Echipa școlii din Brazilia
Fizică Modern - Fizică - Școala din Brazilia
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
ÎNGERI, Talita Alves dos. „De la atomul lui Rutherford la atomul lui Bohr”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm. Accesat la 27 iunie 2021.