La forte intermoleculare sunt un subiect din chimie care, cu siguranță, poate apărea la examenul național de liceu (Si nici). Prin urmare, merită să verificați conținutul principal al acestui subiect în acest articol.
Definiție
forte intermoleculare sunt forțe - de intensități variate (slabe, medii sau puternice) - de atracție electrostatică sau legături stabilite între moleculele unei substanțe care mențin uniunea dintre ele.
Tipuri de forțe intermoleculare
) Dipol indus
Si forța intermoleculară care apare între moleculele unei substanțe cu o caracteristică nepolare. Se întâmplă, de exemplu, între molecule de substanțe precum O2, H2, Nu2, CO2, CH4.
Unirea dintre aceste molecule are loc atunci când se creează un dipol între ele. Acest lucru se întâmplă atunci când electronii unei molecule deplasează electronii alteia, creând astfel un pol negativ și unul pozitiv, care este transferat de la o moleculă la alta.
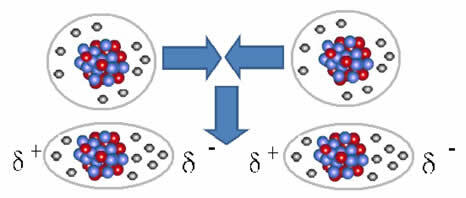
Reprezentarea formării dipolului în molecule nepolare
Între aceste molecule s-au format doi poli, iar polul negativ al unuia interacționează cu polul pozitiv al celuilalt. Deoarece acești poli au fost creați, este o forță intermoleculară de intensitate redusă.
B) dipol permanent
Si forța intermoleculară care apare între moleculele unei substanțe cu o caracteristică polară. Exemple sunt moleculele de substanțe precum HCN, H2O, NH3, CO, CH3Cl.
Unirea dintre aceste molecule se întâmplă atunci când polul negativ al unuia interacționează cu polul pozitiv al celuilalt.
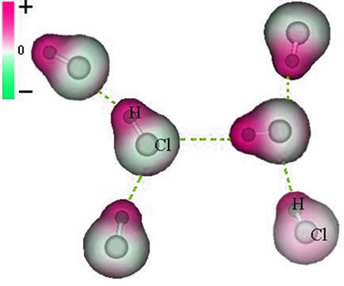
Reprezentarea forței dipolice permanente între moleculele de HCl
Deoarece poli există deja, forța intermoleculară dipol permanentă are o intensitate mai mare decât dipolul indus.
ç) legături de hidrogen
Acea forța intermoleculară apare între moleculele polare care au un atom de hidrogen legat direct de un atom de oxigen, azot sau fluor.
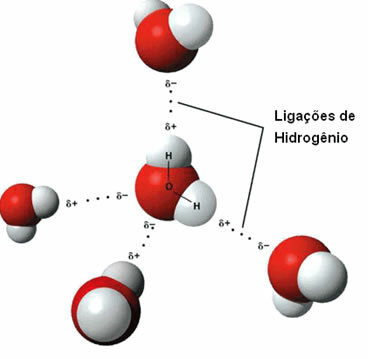
Reprezentarea legăturilor de hidrogen între moleculele de apă
O legătură de hidrogen se formează atunci când hidrogenul dintr-o moleculă interacționează cu oxigenul, azotul sau fluorul celeilalte molecule.
d) ion dipol
Această forță intermoleculară apare între o moleculă polară, care are o pereche de electroni care nu se leagă și un ion (cation sau anion) în soluție.
Molecula de apă, de exemplu, are două perechi de electroni care nu se leagă în oxigen. Dacă există ioni în mediul apos, aceștia se apropie de molecula de apă, deoarece există poli în ea.
Nu te opri acum... Există mai multe după publicitate;)
Importanţă
Importanța cunoașterii forțe intermoleculare pentru Enem este înțelegerea pe care o aduc cu privire la stările fizice, punctul de topire, punctul de fierbere și solubilitatea substanțelor.
) Relația cu punctul de topire și fierbere al substanței
Punctul de topire indică temperatura tranziției de la o stare solidă la una lichidă, iar punctul de fierbere indică temperatura tranziției de la un lichid la o stare gazoasă.
Acest pasaj este direct legat de interacțiunea dintre moleculele substanței, deoarece ceea ce diferențiază o stare fizică de alta este nivelul de agregare între moleculele sale.
Astfel, cu cât forța intermoleculară este mai intensă, cu atât punctele de topire și fierbere sunt mai mari. Cu cât forța intermoleculară este mai puțin intensă, cu atât punctele de topire și fierbere sunt mai mici. Astfel, putem defini ordinea descrescătoare a punctului de topire și de fierbere:
Legătură de hidrogen> dipol permanent> dipol indus
B) Relația cu solubilitatea
În general, ar trebui să știm că, așa cum se dizolvă, cum ar fi, substanța polară dizolvă substanța polară și substanța nepolară dizolvă substanța nepolară.
Cu toate acestea, există încă posibilitatea de interacțiune între moleculele de dizolvat și moleculele de solvent. Acest lucru se întâmplă numai dacă această nouă interacțiune este mai mare decât ceea ce există deja între moleculele substanței în sine.
Exemplu de aplicare a forței intermoleculare în Enem
Primul exemplu: (Enem-2011) Pielea umană, când este bine hidratată, capătă o elasticitate bună și un aspect moale și neted. Pe de altă parte, când este uscat, își pierde elasticitatea și apare opac și aspru. Pentru a preveni uscarea pielii, este necesar, ori de câte ori este posibil, să folosiți creme hidratante, în general fabricate din glicerină și polietilen glicol:

Retenția de apă pe suprafața pielii promovată de hidratanți este o consecință a interacțiunii grupărilor hidroxil ale agenților de umectare cu umiditatea conținută în mediu prin:
a) legături ionice
b) Forțele londoneze
c) legături covalente
d) forțele dipol-dipol
e) legături de hidrogen
Răspunsul la această întrebare este legarea de hidrogen, deoarece molecula de apă are legătură de hidrogen la un atom de oxigen. La fel se întâmplă și cu moleculele de propilen glicol și polietilen glicol, o condiție favorabilă apariției acestui tip de forță intermoleculară.
De mine. Diogo Lopes Dias
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
ZILE, Diogo Lopes. „Forțele intermoleculare în Enem”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Accesat la 27 iunie 2021.



