“Legătura chimică ”a fost un termen folosit pentru prima dată de Gilbert Newton Lewis în anul 1920 într-un articol pentru a explica de ce că atomii se lipesc împreună pentru a forma substanțe și, de asemenea, de ce se lipesc împreună de mii de varsta.
Atomii celor mai multe elemente chimice cunoscute până acum și enumerate în Tabelul periodic nu apar în formă izolată în natură. Majoritatea materialelor prezente în viața noastră de zi cu zi sunt substanțe care pot fi simple (constând din atomi a unui singur tip de element chimic) sau compozite (au atomi de două sau mai multe elemente chimice multe diferite).
Acest lucru se datorează faptului că atomii au capacitatea de a face legături chimice cu alți atomi, care pot fi același element sau elemente diferite. Aceste legături sunt atât de puternice încât fără nicio influență externă, în majoritatea cazurilor atomii vor rămâne uniți așa cum sunt.
Harta mentală: legături chimice

* Pentru a descărca harta mentală în format PDF, Click aici!
De exemplu, nu este obișnuit să găsești un atom de oxigen liber în natură; cu toate acestea, găsim mai multe substanțe în care apare atașat de alți atomi. Un exemplu de substanță simplă este oxigenul gazos în care fiecare moleculă este formată din doi atomi de oxigen legați (O
2); în timp ce un exemplu de substanță compusă este apa, unde fiecare moleculă are doi atomi de hidrogen legați de un atom de oxigen (H2O).Singurele elemente care se găsesc stabil izolate în natură sunt gaze nobile, adică elementele familiei 18 din Tabelul periodic (He, Ne, Ar, Kr, Xe și Rn). Toate aceste elemente au în comun faptul că au opt electroni în ultimul înveliș de electroni (stratul de valență), cu excepția heliului (He), care are doar o singură coajă de electroni (stratul K) și, prin urmare, deține doi electroni, care este numărul maxim posibil de electroni din acesta strat.
Astfel, Gilbert N. Lewis și, de asemenea, omul de știință Water Kossel au ajuns la concluzia că atomii celorlalte elemente se leagă pentru a avea opt electroni (sau doi, dacă aveți doar carcasa K) și astfel se stabilizează. A fost creat, apoi, teoria electronică a valenței, care indică câte legături chimice face atomul unui element, pe baza ideii explicate.
Prin urmare, atomii fac legături chimice, căutând să piardă, să câștige sau să împartă electronii de valență până când ajung la configurația următorului gaz nobil.Această teorie a ajuns de asemenea să fie numită regula octetului.
De exemplu, oxigenul este bivalent deoarece are șase electroni în învelișul său de valență. Prin urmare, trebuie să primească încă doi electroni pentru a avea o configurație a neonului cu gaz nobil (Ne), adică cu opt electroni în învelișul de valență, care în acest caz este învelișul L. În cazul oxigenului gazos și al apei menționate, avem următoarele:
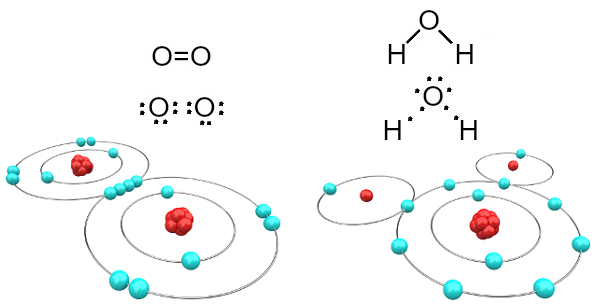
Molecule de oxigen și apă formate din legături covalente
Rețineți că, în primul caz (oxigen gazos - O2), fiecare atom de oxigen împarte doi electroni, ambii având opt electroni în carcasa de valență. Aceasta înseamnă că a dublă legătură (două legături în același timp între doi atomi).
În cazul apei, fiecare dintre cei doi atomi de hidrogen împarte un electron cu atomul central de oxigen și toate sunt stabile (oxigenul are opt electroni în învelișul de valență și fiecare hidrogen are doi electroni). Aici sunt făcute și două conexiuni simple.
Acest tip de legătură chimică, în care toți atomii trebuie să primească electroni (hidrogen, nemetale și semimetale) și în care electronii sunt împărțiți în perechi, se numește legătură covalentă.
Dar există încă două tipuri de legături chimice:
(1) legătură ionică → există transferul definitiv de electroni de la un atom la altul. Acest tip de legătură are loc între atomi de metal (care au tendința de a pierde electroni pentru a rămâne stabile) și atomi de hidrogen, nemetale și semi-metale (care au tendința de a câștiga electroni pentru a rămâne grajd).
Un exemplu este clorura de sodiu (NaCl - sare de masă) în care sodiul este un metal care are tendința de a pierde un electron, în timp ce clorul este un nemetal care are tendința de a câștiga un electron. Astfel, sodiul donează(sageata rosie)un electron în clor, formând sare, o substanță foarte stabilă. De când absolvesc (sageata neagra) ioni, care sunt specii chimice cu sarcini opuse (+ și -), un ion atrage altul în apropiere și grupurile ionice se formează cu un număr mare de ioni, la fel ca și cristalele din sarea de masă.

Formarea clorurii de sodiu prin legare ionică
(2) Conexiune metalică → Este o teorie conform căreia metalele (precum aluminiu, aur, argint, cupru etc.) sunt formate dintr-un grup de atomi de neutroni și cationii care sunt tinuti impreuna de un fel de "nor" de electroni liberi (electroni care s-au pierdut in formarea cationilor citat). Acest nor (sau mare) de electroni ar acționa ca o legătură metalică care ar menține atomii laolaltă.
Pentru mai multe detalii despre aceste tipuri de legături chimice, precum și regula octetului, citiți articolele aferente de mai jos.
Mind Map De M.e Victor Ricardo Ferrreira
Profesor de chimie
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-ligacao-quimica.htm
