Înainte de a introduce conceptul de masa molară și numărul molar, să analizăm câteva definiții importante în acest context:
→ Termen molar
Molar provine din cuvânt moleculă, dar ce este mai exact o moleculă? Este setul de atomi care sunt legați prin legături chimice.
→ Masa moleculară (MM)
Este posibil să se calculeze masa unei molecule prin suma maselor atomice ale fiecărui atom care alcătuiește molecula respectivă. Rezultatul se numește Masă moleculară (MM).
Care ar fi masa moleculară a hidrogenului sulfurat (H2S) de exemplu?
Mai întâi trebuie să știți ce masă atomică din fiecare atom, care este dat de tabelul periodic al elemente.
Masa atomică de hidrogen (H) = 1 a.m.u. (unitate pe masă atomică)
Masa atomică de sulf (S) = 32,1 a.u.u.
Masa moleculară este suma maselor atomice ale atomilor.
Notă: hidrogenul moleculei H2S are un coeficient de 2, deci trebuie să-i înmulțiți masa cu 2. De calculat:
Masa moleculară a H2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Masa molară și numărul de moli
Nu te opri acum... Există mai multe după publicitate;)
Masa molară, precum și numărul de moli, sunt legate de Constanta lui Avogadro (6,02 x 1023) prin următorul concept:
'' Numărul de entități elementare conținute într-un mol corespunde constantei lui Avogadro, a cărei valoare este 6,02 x 1023 mol-1.''
Prin urmare, masa molară este masa de 6,02 x 1023 entități chimice și se exprimă în g / mol.
Harta Mentală - Mol
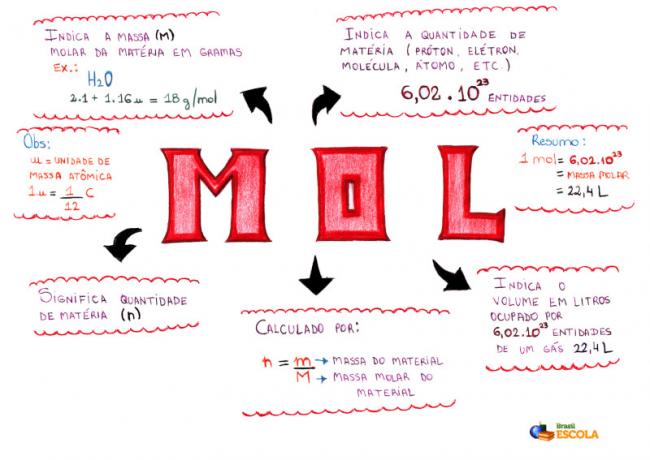
* Pentru a descărca harta mentală, Click aici!
Exemplu: H2s
Masa moleculară = 34,1 u
Masa molară (M) = 34,1 g / mol
Aceasta înseamnă că, la 34,1 g / mol de hidrogen sulfurat, avem 6,02 x 1023 molecule sau 1 mol de molecule de hidrogen sulfurat.
Concluzie
Masa moleculară și masa molară au aceleași valori, ceea ce diferă este unitatea de măsură. Masa molară este legată de numărul de moli dat de constanta lui Avogadro.
* Mind Map by Me. Diogo Lopes
De Líria Alves
Absolvent în chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
SOUZA, Líria Alves de. „Masa molară și numărul molar”; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Accesat la 27 iunie 2021.

