Acid clorhidric este un hidracid cu potențial mare de ionizare, este un lichid gălbui, foarte coroziv și toxic. Este utilizat în diverse procese industriale, cum ar fi fabricarea produselor de curățare și a clorhidratelor farmaceutice, în alimente și în procesele de fabricare a oțelului.
Este prezent și în organismul uman; O suc gastric care acționează în digestia proteine este o soluție acidă; de clorhidric și alte substanțe, cum ar fi enzime și săruri. Expunere, inhalare sau ingestie de acidul clorhidric concentrat este extrem de dăunător pentru sănătate, care poate provoca chiar moartea.
Citește și: Acid sulfuric - substanță care are o putere corozivă ridicată
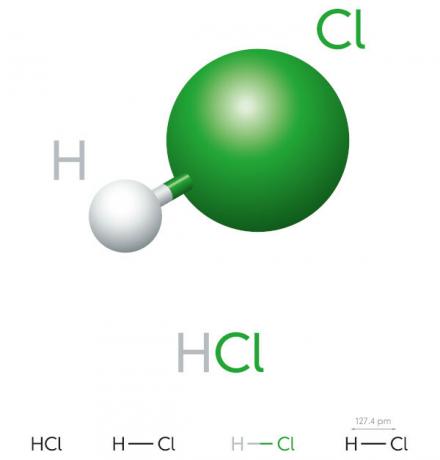
Proprietăți de acid clorhidric
- compus anorganic
- acid puternic
- Potențial ridicat de ionizare
- Lichid
- aspect gălbui
- Toxic
- Coroziv
- Volatil
- Higroscopic (tinde să se absoarbă áapă de mediu)
- Solubil în apă
Nu te opri acum... Există mai multe după publicitate;)
Producerea acidului clorhidric
Acidul clorhidric a fost descoperit de un alchimist musulman numit Jabir Ibne Haiane, cunoscut și sub numele de Gaber și considerat tatăl chimiei arabe. El a sintetizat substanța pe baza unui reacție între sarea de mare (NaCl) și acid sulfuric (La2NUMAI4).
2NaCl + H2NUMAI4 → În2NUMAI4 + 2HCl
În prezent acid clorhidric este produs pe scară largă prin electronicóliza de clorură de sodiu în soluție apoasă. Din acest proces se obține gaz clor (Cl2), gaz hidrogen (H2) și hidroxid de sodiu (NaOH). Gazele cu clor și hidrogen reacționează pentru a forma acid clorhidric:
Cl2 + H2 → 2HCl
In orice caz, această reacție este extrem de mare exoterm și extrem de periculos. În prezent, cea mai mare parte a acidului clorhidric produs industrial este asociat cu producerea de compuși organici, fiind un proces mai economic și mai sigur.
R-H + CI2 → R-Cl + HCI
(Considerați că R este un radical organic.)
Vezi și: Sfaturi pentru a determina-dacă puterea acizilor

Aplicarea acidului clorhidric
- Decaparea metalelor: Acidul clorhidric este utilizat pentru a „curăța” metalele înainte de a fi procesate, îndepărtând rugina, solziul și alte impurități de pe suprafața lor.
- Producția de compuși organici: acidul clorhidric este utilizat ca reactiv pentru obținerea clorurii de vinil, care este utilizat la fabricarea materialelor plastice. Acidul clorhidric provine și din cloropren, care este utilizat în cauciucurile sintetice.
- Producția de compuși anorganici: acidul clorhidric este prezent în mai multe procese industriale pentru fabricarea reactivilor și a compușilor anorganice, printre acestea se numără și produsele pentru tratarea apei, precum clorura de fier (III) și aluminiu.
- Folosit ca produs de curățare: De asemenea, comercializat ca acid muriatic, acidul clorhidric este utilizat pentru curățarea post-construcție, casnică și chimică a sculelor și a mașinilor.
- Prelucrare alimentară: Acidul clorhidric este utilizat în diferite reacții pentru producerea de alimente și aditivi, cum ar fi hidroliza amidonului și proteinelor, sau în produsul final pentru echilibrarea pH-ului.
- Producția de medicamente: Acidul clorhidric este utilizat la producerea clorhidratelor solubile prezente în mai multe medicamente, cum ar fi clorhidratul de doxiciclină, utilizat în tratamentul febră tifoidă și variolă.
Acid clorhidric din organism
Acidul clorhidric este prezent în sistem digestiv, sucul gastric produs de stomacul nostru este o soluție de apă, enzime, acid clorhidric, săruri anorganice și un procent mic de acid lactic.
O prăjitura alimentară se transformă în chyme, o masă acidă (datorită acțiunii sucului gastric și compoziției sale acide), acesta este momentul în care digestia de proteine, transformat în polipeptide și aminoacizi care va fi absorbit de corp.
Pericole cu acid clorhidric
Acidul clorhidric este un acid foarte puternic și coroziv, astfel încât contactul cu substanța provoacă mai multe daune:
- Piele: Provoacă arsuri și iritații.
- Ochi: Provoacă iritații severe și poate provoca orbire.
- Inhalare: Provoacă iritații și vătămări ale căilor respiratorii superioare.
- ingestie: provoacă coroziune în întregul sistem oral, iar în tractul gastro-intestinal, poate provoca vărsături, sângerări, diaree, probleme de circulație, care pot duce la moarte.
- Expunereva urma: atacă mai întâi zonele mucoasei, provocând dermatită și conjunctivită, sângerarea gingiilor, fotosensibilizare; inhalarea frecventă, chiar și în concentrație scăzută a compusului, poate provoca gastrită și sângerări nazale.
De asemenea, accesați: Caracteristici și proprietăți ale acidului acetic

exerciții rezolvate
Intrebarea 1 - (Udesc) În ceea ce privește acidul clorhidric, se poate afirma că:
A) în soluție apoasă, permite trecerea curentului electric.
B) este un diacid.
C) este un acid slab.
D) are un grad scăzut de ionizare.
E) este o substanță ionică.
Rezoluţie
Alternativa A. Acidul clorhidric nu este un diacid, deoarece are doar un H ionizabil, ci unul acid puternic, substanță moleculară cu potențial mare de ionizare. THE ionizare într-un mediu apos favorizează conducerea de curent electric datorită existenței ionilor liberi.
Intrebarea 2 - Într-o soluție de acid clorhidric și apă, putem spune că apariția clorurii de hidrogen molecular (HCl) este minimă, acest lucru se datorează faptului că
A) acidul clorhidric în contact cu apa se diluează.
B) clorura de hidrogen este o substanță care nu se solubilizează în apă.
C) clorura de hidrogen are un potențial ridicat de ionizare, prin urmare, atunci când se află într-un mediu apos, molecula HCl formează ioni H+ Cl-.
D) acidul clorhidric, deoarece este foarte volatil, se separă de soluție, lăsând doar molecule de apă.
E) acidul clorhidric este o substanță ionică, prin urmare, într-o soluție apoasă, se disociază, formând ioni.
Rezoluţie
Alternativa C.
A) Răspunsul nu este de acord cu întrebarea, diluarea acidului clorhidric în apă nu justifică absența HCI moleculară.
B) Incorect, clorura de hidrogen este solubilă și are o afinitate pentru apă.
C) Corect
D) Deși acidul clorhidric este volatil, această segregare a celor două specii în soluție nu are loc semnificativ.
E) Acidul clorhidric este o soluție de clorură de hidrogen și apă, unde clorura de hidrogen este o substanță moleculară neionică.
De Laysa Bernardes Marques de Araujo
Profesor de chimie
Doriți să faceți referire la acest text într-o școală sau într-o lucrare academică? Uite:
ARAúJO, Laysa Bernardes Marques de. "Acid clorhidric"; Școala din Brazilia. Disponibil in: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Accesat la 27 iunie 2021.

