DE Octettheorie stelt dat voor een atoom van een chemisch element om stabiel te zijn, het de elektronische configuratie van een edelgas moet verwerven, dat wil zeggen, het moet acht elektronen in de valentieschil hebben of twee elektronen als het atoom alleen de eerste elektronenschil heeft. (K).
Beryllium heeft een atoomnummer gelijk aan 4. Daarom heeft je atoom 4 elektronen en de elektronische verdeling in de grondtoestand wordt gegeven door:

Beryllium elektronische configuratie
Dit betekent dat beryllium 2 elektronen in zijn laatste schil heeft, afkomstig uit de 2A-familie (aardalkalimetalen). Het zou dus de neiging hebben om deze twee elektronen te doneren en de lading 2+ te krijgen, dat wil zeggen, het zou de neiging hebben om ionische bindingen te vormen.
Er wordt echter waargenomen dat berylliumatomen covalente bindingen maken, met elektronendeling, zoals weergegeven in de hieronder gevormde verbinding, berylliumhydride (BeH2):
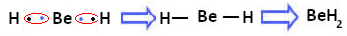
Vorming van covalente bindingen van beryllium met waterstof
Merk op dat in dit geval beryllium stabiel is met minder dan acht elektronen in zijn valentieschil, omdat de deelt zijn elektronen als waterstofatomen, het heeft nu vier elektronen in zijn laatste laag. Het is dan ook een uitzondering op de octetregel.
Maar covalente binding treedt meestal op omdat het element onvolledige orbitalen heeft. Zoals hieronder wordt getoond, heeft waterstof bijvoorbeeld een onvolledige orbitaal, dus het maakt maar één covalente binding. Zuurstof heeft twee onvolledige orbitalen en maakt twee covalente bindingen. Stikstof heeft op zijn beurt drie onvolledige orbitalen en maakt bijgevolg drie covalente bindingen:
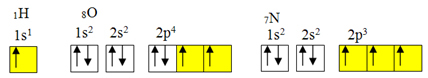
Elektronische distributie van waterstof, zuurstof en stikstof
Zoals echter al is aangetoond, heeft beryllium geen onvolledige orbitalen.
Niet stoppen nu... Er is meer na de reclame ;)
Dus waarom maakt het covalente bindingen?
De uitleg staat in de hybridisatie theorie, die zegt dat wanneer een elektron uit een orbitaal energie ontvangt, "springt" het naar een buitenste lege orbitaal, in de aangeslagen toestand blijven en dus de fusie of vermenging van onvolledige atomaire orbitalen plaatsvindt, genereren hybride orbitalen die gelijkwaardig zijn aan elkaar en verschillen van de oorspronkelijke zuivere orbitalen.
In het geval van beryllium ontvangt een elektron van subniveau 2s bijvoorbeeld energie en gaat het over naar een subniveau 2p-orbitaal die leeg was:

Beryllium-aangeslagen toestand voor de vorming van hybride orbitalen
Op deze manier heeft beryllium twee onvolledige orbitalen en kan het twee covalente bindingen maken.
Merk op dat de ene orbitaal zich in een "s"-subniveau bevindt en de andere in de "p", dus de bindingen die beryllium zou uitvoeren, zouden anders moeten zijn. Dit is echter niet wat er gebeurt, want met het fenomeen van hybridisatie, deze onvolledige orbitalen die gevormd zijn, zullen zich vermengen, waardoor twee orbitalen worden gegenereerd die worden genoemd hybriden of gehybridiseerd, die aan elkaar gelijk zijn. Bovendien, aangezien deze twee hybride orbitalen afkomstig zijn van een "s" orbitaal en een "p" orbitaal, zeggen we dat deze hybridisatie van het type is sp:

Beryllium sp hybridisatie vorming
Omdat de hybride orbitalen hetzelfde zijn, zullen de covalente bindingen die beryllium maakt met de waterstofatomen ook hetzelfde zijn:

Interpenetraties van hybride beryllium-orbitalen met s-orbitalen van waterstofatomen
Merk op dat het dan twee sigma-bindingen maakt die van het type s-sp zijn (σs-sp).
Door Jennifer Fogaça
Afgestudeerd in scheikunde