Meestal zijn de reacties van waterige elektrolyse en stollingselektrolyse ze worden uitgevoerd met grafiet- en platina-elektroden, die niet deelnemen aan de reactie; ze geleiden alleen elektrische stroom. Er zijn echter enkele specifieke gevallen waarin het nodig is om actieve elektroden, dat wil zeggen, die reductie en oxidatie ondergaan.
De belangrijkste use-cases van deze elektroden die deelnemen aan het redoxproces zijn: elektrolytische metaalzuivering, zoals zink, kobalt, nikkel en in het bijzonder koper; en ook de galvaniseren. Laten we eens kijken hoe elk geval zich voordoet:
• Koper elektrolytische zuivering: deze elektrolytische koperraffinage kan een zuiverheid van ongeveer 99,9% produceren en wordt voornamelijk gebruikt om koperdraden die, als ze de minste hoeveelheid onzuiverheid bevatten, zeer elektrische stroom kunnen geleiden verminderd.
Bekijk hoe dit proces plaatsvindt, zie het schema van een elektrolytisch vat dat hieronder is gemonteerd:

Er wordt een potentiaalverschil toegepast op de waterige kopersulfaatoplossing (CuSo
4(aq)) - die elektriciteit geleidt - zodat de anode, die een onzuiver metallisch koper is, elektronen verliest, dat wil zeggen, het ondergaat oxidatie, waarbij zijn kationen vrijkomen (Cu2+), die op de negatieve plaat worden afgezet. Dit kan een inerte platinaplaat zijn, of, beter nog, een puur koperen plaat. Het vormt de kathode, die wordt gereduceerd naarmate er koper in wordt afgezet. De semi-reacties die optreden in de elektroden zijn dus:Niet stoppen nu... Er is meer na de reclame ;)
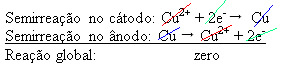
Het feit dat het een nulresultaat gaf, geeft aan dat er geen chemische reactie was, maar alleen het transport van koper. Op de bodem van de container zitten de andere onzuivere stoffen die in koper zaten zoals goud, zilver, silica (zand) en andere mineralen, die zelfs verkocht kunnen worden.
• Galvaniseren: een metallische coating wordt aangebracht op een materiaal dat moet worden beschermd tegen corrosie.
Het gekozen metaal voor de coating - dat kan chroom (verchromen), nikkel (vernikkelen), zilver (verzilveren), goud (vergulden) of zink (galvanisatie) - zal de anode zijn, de positieve elektrode, die oxidatie ondergaat en elektronen verliest. Het ondergaat oxidatie in plaats van het beschermde materiaal, omdat het reductiepotentieel groter is.
De negatieve elektrode, dat wil zeggen de kathode, die deze elektronen ontvangt en reductie ondergaat, is het materiaal zelf dat werd gecoat. Op deze manier blijft het beschermd, zelfs als het oppervlak op de een of andere manier wordt geschonden.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Elektrolyse met actieve elektroden"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm. Betreden op 28 juni 2021.


